
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Промежуточные филаменты образуются из димерных субъединиц со стержневидным срединным доменом
|
|
|
|
11-28
[53]
Несмотря на значительную разницу в размерах, все белки ПФ цитоплазмы кодируются генами одного мультигенного семейства. У всех этих белков в первичной структуре полипептида есть гомологичный срединный участок примерно из 310 аминокислот, образующий протяженную а-спираль с тремя короткими не-α-спиральными вставками (рис. 11-74). Кроме того, большие отрезки этой срединной области имеют последовательность, характерную для полипептидов, способных к образованию спирали из двух спиралей (см. разд. 11.1.6). Подобно тропомиозину или хвосту мышечного миозина, эта двухцепочечная спираль представляет собой димер из двух одинаковых полипептидов ПФ. Эти две цепи в гомодимере ПФ уложены параллельно друг другу, причем к срединному стержневидному домену примыкают на обоих концах глобулярные домены. При сборке ПФ стержневидные домены взаимодействуют друг с другом и формируют однородную сердцевину филамента, а глобулярные, величина которых сильно варьирует у разных белков ПФ, выступают с поверхности филамента наружу. Одна из моделей сборки ПФ из димерных субъединиц показана на рис. 11-75.
11.5.3. Промежуточные филаменты простираются от ядерной оболочки до периферии клетки [54]
Если окрасить культивируемые клетки антителами к одному из цитоплазматических белков ПФ (например, виментину), то обычно будет видна ажурная сеть нитей, окружающая ядро и охватывающая всю, цитоплазму (см. рис. 11-73). По структуре эта сеть отлична от других компонентов цитоскелета, хотя местами ее нити, по-видимому, идут параллельно микротрубочкам цитоплазмы. Вероятно, организация цитоплазматических ПФ зависит от взаимодействия с микротрубочками, так как деполимеризация микротрубочек при обработке веществами типа колхицина ведет к «осаждению» всей сети ПФ в виде околоядерной «шапки». Можно думать, что многие ПФ цитоплазмы связаны с ядерной оболочкой и в норме оттягиваются от нее к периферии клетки микротрубочками, с которыми они соединены.
Организация ПФ в цитоплазме может также определяться их взаимодействием с плазматической мембраной. В эритроцитах птиц (которые
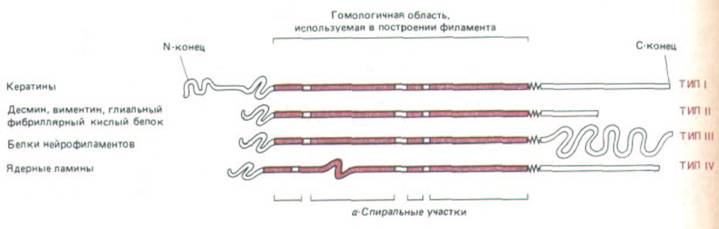
Рис. 11-74. У всех белков промежуточных филаментов имеется гомологичная центральная область (около 310 аминокислотных остатков), формирующая протяженную α-спираль с тремя короткими участками иной структуры. N-концевой и С-концевой домены не состоят из α -спирали и сильно варьируют по размерам и последовательности аминокислот у белков разных промежуточных филаментов.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
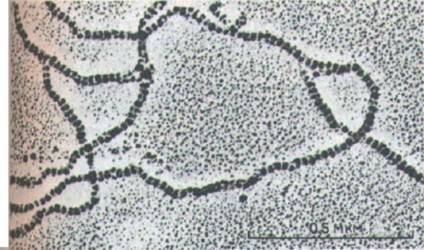


Рис. 11-75. Одна из современных моделей сборки промежуточных фнламентов (ПФ). Мономер (А) объединяется с таким же мономером, образуя димер (Б), в котором консервативные α-спиральные участки лежат параллельно, обвиваясь друг около друга. Затем два таких димера укладываются бок о бок, образуя протофиламент длиной 48 нм и толщиной 3 нм, который состоит из четырех полипептидных цепей (В). Такие протофиламенты затем образуют все более крупные структуры, укладываясь с продольным сдвигом (Г и Д). Окончательная структура промежуточного филамента толщиной 10 нм состоит из восьми рядов протофиламентов (32 полипептидных цепей), соединенных в длинный тяж, похожий на канат (Е). Вверху представлена электронная микрофотография такого «окончательного» филамента. Неизвестно, являются ли ПФ полярными структурами, как актин и тубулин, или неполярными, как двойная спираль ДНК (или, что то же самое, лежат ли две скрученные спирали в составе протофиламента в параллельной ориентации или же в антипараллельной. (Микрофотография любезно предоставлена N. Geisler и К. Weber.)
в отличие от эритроцитов млекопитающих имеют ядро и ПФ) виментин, как полагают, связан с плазматической мембраной через анкирин (разд.
6.2,4). В эпителиальных клетках кератиновые ПФ присоединены к плазматической мембране в десмосомах - специализированных межклеточных соединениях, помогающих удерживать соседние клетки вместе (разд. 14.1.4). Так как кератиновые филаменты каждой клетки через десмосомы соединены с такими же филаментами соседних клеток, они образуют непрерывную сеть, охватывающую весь эпителий.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 513; Нарушение авторских прав?; Мы поможем в написании вашей работы!