
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Инозитолтрисфосфат (InsP3) сопрягает активацию рецептора с освобождением Са2 из внутриклеточных
|
|
|
|
12-14
12-17
12.3.5 Gs -белок - гетеротример, диссоциирующий при активации на субъединицы [13]
Функция Gs -белка решающим образом зависит от его субъединичной структуры. В его состав входят три полипептида: α-цепь (Gsα), которая связывает и гидролизует GTP и активирует аденилатциклазу, и прочный комплекс β-цепи и γ-цепи (Gβγ), который заякоривает Gs на внутренней

Рис. 12-16. Функционально активные адреналиновые рецепторы можно экстрагировать из клеток, в которых аденилатциклаза инактивирована нагреванием, и встроить в плазматическую мембрану клеток, не имеющих таких рецепторов. При активации адреналином «пересаженные» рецепторы активируют аденилатциклазу в плазматической мембране клеток-реципиентов (сопрягающий рецепторы и циклазу G-
белок на схеме не показан). Существует по меньшей мере три типа адреналиновых рецепторов (называемых также адренэргическими) - α1, α2 и β;
аденилатциклазу активируют только β -рецепторы.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-17. Современная модель, иллюстрирующая, каким образом белковые рецепторы могут функционально сопрягаться с аденилат-
циклазой через стимулирующий G-белок-GS,. Пока сигнальный лиганд остается связанным, рецепторный белок может активировать все новые молекулы GS-белка, усиливая таким образом ответ. Дополнительный механизм усиления (который в некоторых сигнальных системах имеет большее значение) заключается в удержании связанного GTP на α-субъединице GS,-белка на протяжении многих секунд, так что все это время аденилатциклаза остается активированной. Согласно другой модели, аденилатциклаза остается связанной с GS и в активированном, и в неактивном состоянии.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
стороне цитоплазматической мембраны. На рис. 12-17 показана современная модель сопряжения активации рецептора с активацией аденилат-
циклазы при помощи Gs. В своей неактивной форме Gs существует как тример, с α-субъединицей которого связан GDP. При активации гормон-
рецепторным комплексом участок связывания гуаниловых нуклеотидов на Gs изменяется, и теперь вместо GDP здесь может присоединиться GTP.
Как полагают, в результате присоединения GTP Gsa отделяется от Gβγ и прочно связывается с молекулой аденилатциклазы, которая при этом активируется и начинает синтезировать сАМР. Менее чем за минуту Gsa гидролизует связанный с нею GTP до GDP, что приводит к отделению Gsa от аденилатциклазы (которая становится неактивной) и обратному присоединению Gsa к Gβγ с восстановлением неактивной молекулы Gs.
В аденилатциклазной системе бактерий нет промежуточного звена в виде GS. Почему же тогда у животных клеток выработался столь сложный многоступенчатый механизм передачи сигнала с участием G-белка, «вставленного» между рецептором и активируемым ферментом?
Одной из причин может быть необходимость усиления сигнала (см. разд. 12.4.6), а другой-нужда в дополнительных уровнях для контроля.
GS позволяет создать два вида усиления. В простейшем случае единичный активированный белковый рецептор может в принципе успеть столкнуться с многими молекулами СS-белка (и тем самым активировать их), а они затем вызовут активацию многих молекул аденилатциклазы. В ряде случаев, однако, внеклеточный лиганд может не связываться со своим рецептором на достаточно длительное время, чтобы мог сработать этот механизм усиления: некоторые лиганды, например, отделяются от своих рецепторов быстрее чем за секунду. Между тем сам Gs, как полагают, остается активным более 10-15 с, прежде чем произойдет гидролиз связанного с ним GTP. Таким образом, он будет удерживать аденилатциклазу в активном состоянии довольно долго даже после отделения внеклеточного лиганда. Подобный эффект можно продемонстрировать в преувеличенном виде, если к разрушенным клеткам добавить негидролизуемый аналог GTP: последующая обработка гормоном приводит к весьма продолжительному синтезу сАМР.
G-белки не только усиливают сигнал, но и служат важным звеном, где может регулироваться весь процесс активации. В принципе эффективность взаимодействия между рецепторами и ферментом может быть изменена ковалентной модификацией G-белка или изменением его концентрации в плазматической мембране. Наиболее впечатляющая иллюстрация этого - действие бактериального токсина, ответственного за симптомы холеры. Холерный токсин представляет собой фермент, катализирующий перенос ADP-рибозы с внутриклеточного NAD на а-
субъедини-цу GS-белка. Последняя при этом теряет способность гидролизовать связанный с нею GTP. Аденилатциклаза, активированная такой видоизмененной α-субъединицей GS-белка, может оставаться в активном состоянии неопределенно долго. В результате длительное повышение уровня сАМР в клетках кишечного эпителия вызывает массированный выход воды и натрия из этих клеток в просвет кишечника, что и приводит к тяжелому поносу - характерному симптому холеры.
GS- только один из представителей большого семейства G-белков, обеспечивающих сопряжение рецепторов с разнообразными ферментами и ионными каналами в мембранах эукариотических клеток. Как мы сейчас увидим, другой представитель этого семейства не активирует, а, наоборот, ингибирует аденилатциклазу.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
12.3.6 Рецепторы подавляют активность аценилатциклазы через ингибирующий G-белок (Gi) [13]
Одна и та же сигнальная молекула может как повышать, так и понижать внутриклеточную концентрацию сАМР в зависимости от типа рецептора, с которым она связывается. Например, есть несколько типов рецепторов для адреналина: β -адренэргические рецепторы активируют адени-латциклазу, а α 2-адренэргические ингибируют ее. Различный конечный эффект определяется G-белками, осуществляющими сопряжение этих рецепторов с аденилатциклазой: β-рецепторы действуют через Gs, а α2-рецепторы - через ингибиторный G-белок (Gi), который содержит тот же βγ-
комплекс, что и Gs, но другую α-субъединицу (Gia). Будучи активирован, а2-адренэргический рецептор взаимодействует с Gβγ приводя к замене GDP на GTP в участке связывания гуаниловых нуклеотидов на α-субъединице. При этом, как полагают, Gia отделяется от Gβγ и обе эти субъединицы участвуют в ингибировании аденилатциклазы: Gia прямо подавляет активность аденилатциклазы, тогда как действие Gβγ обусловлено связыванием свободной Gsа-субъединицы и, как следствие, устранением ее активирующего влияния на аденилатциклазу.
Подобно тому как холерный токсин повышает уровень сАМР, ADP-рибозилируя субъединицу Gsa и инактивируя ее GTP-азную активность, коклюшный токсин-продукт бактерий, вызывающих коклюш, - дает тот же эффект, ADP-рибозилируя Gia. В этом случае, однако, модификация G-белка препятствует его взаимодействию с рецепторами; поэтому при активации рецептора аденилатциклаза не ингибируется.
Хотя G-белки были открыты благодаря их влиянию на аденилатциклазу, они могут действовать и другими путями (см. табл. 12-3). В частности, активируя фосфолипазу С (разд. 12.3.9), некоторые G-белки могут
| Таблица 12-3. Некоторые GTP-связывающие регуляторные белки, участвующие в передаче сигнала в клетке | |||
| Тип G-белка | a-Субъединица1 | Функция | Модифицирующий бактериальный токсин |
| Gs | 
| Активация аденилатциклазы | Холерный |
| Gi | 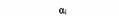
| Инактивация аденилатциклазы | Коклюшный |
| Gp | 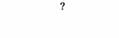
| Активация фосфоинозитид-специфической фосфо- липазы С | Коклюшный (только в некоторых клетках) |
| GO | 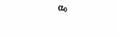
| Главный G-белок головного мозга; может регулировать ионные каналы | Коклюшный |
| Трансдуцин | 
| Активация cGMP-фосфо-диэстеразы в палочках сетчатки позвоночных (см. разд. 12.3.12) | Коклюшный и холерный |
| ras-Белки | 
| Участвуют в стимуляции клеточного деления факторами роста (см. разд. 12.3.11 и 13.4.5) | |
| 1 За исключением ras-белков (и Gp, структура которого не ясна), G-белки - гетеротримеры, в которых а-субъединица непрочно связана с димером βγ. Все известные α-субъединицы (мол. масса 40000-50000) гомологичны, и у большинства из них одинаковые (или очень сходные) β- субъединицы (мол. масса 35 000) и γ-субъединицы (мол. масса 8000). | |||
| 2 ras-Белки- одиночные полипептиды (мол. масса 21 000), гомология которых с субъединицами других G-белков незначительна; участвуют ли они в сопряжении рецепторов с эффекторными белками таким же образом, как другие G-белки, не известно. |
связывать активацию рецептора с изменением концентрации Са2+ в цитозоле, а Са2+ используется как внутриклеточный посредник еще более
широко, чем сАМР.
12.3.7 Ионы Са2+ запасаются в специальном внутриклеточном компартменте [14]
Концентрация свободных ионов Са2+ в цитозоле клеток очень низка (порядка 10 -7 М), тогда как концентрация их во внеклеточной жидкости (более 10 -3 М) и в специальном внутриклеточном запасающем Са2+ компартменте довольно высока. Столь значительный градиент ионов Са2+ стремится «проталкивать» их в цитозоль через плазматическую мембрану и мембрану запасающих внутриклеточных органелл. Когда какой-то сигнал на короткое время открывает в этих мембранах Са2+ -каналы, ионы Са2+ буквально врываются в цитозоль, резко повышая свою локальную концентрацию и активируя чувствительные к ним механизмы в клетке.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
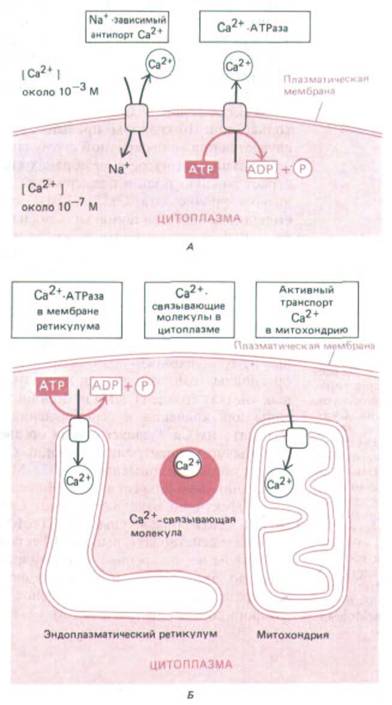
Рис. 12-18. Важнейшие механизмы, позволяющие клетке поддерживать очень низкую концентрацию свободных ионов Са2+ в цитозоле, несмотря на их высокую концентрацию во внеклеточной жидкости. Саг+ активно откачивается из цитозоля во внеклеточное пространство (А) и в окруженные мембраной внутриклеточные органеллы, запасающие Са2 + (Б). Кроме того, свободные ионы кальция прочно связываются различными внутриклеточными молекулами. Митохондрии тоже способны откачивать Са + из цитозоля, но делают это эффективно только при очень высокой концентрации Са2 +, создающейся обычно при повреждении клетки.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
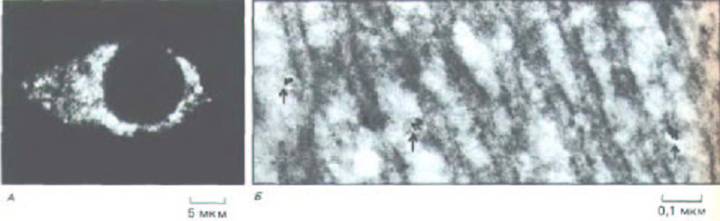
Рис. 12-19. Внутриклеточные депо для ионов Са2+, выявляемые с помощью антител к Ca2 + -связывающему белку кальсеквестрину. А.
Иммунофлуоресцентная микрофотография нервной клетки крысы в культуре; видно, что места связывания кальция встречаются во всей цитоплазме. Б. Электронная микрофотография замороженного тонкого среза крысиной печени. Судя по распределению антител, меченных коллоидным золотом (указаны стрелкой), ионы Са2+ запасаются не в гранулярном эндоплазматическом ретикулуме, хотя они могут быть в каких-то элементах гладкого ретикулума. Количественный анализ таких электронных микрофотографий позволил оценить объем запасающих органелл - он составляет менее 1% объема клетки. (А - P. Volpe et al., Proc. Natl. Acad. Sci. USA 85: 1091-1095, 1988; Б- любезно предоставлено J. Meldolesi.)
Для работы этого сигнального механизма в цитозоле должна поддерживаться низкая концентрация Са2 +, и это достигается несколькими способами (рис. 12-18). Все эукариотические клетки имеют в своей плазматической мембране Са2 + -зависимую АТРазу, которая использует энергию расщепления АТР для откачивания ионов Са2+ из цитозоля. У мышечных и нервных клеток, особенно широко использующих сигнализацию с помощью Са2 +, в плазматических мембранах есть дополнительный кальциевый насос, который связывает выход Са2+ с поступлением в клетку Na+. Этот Na+ -Са2 + -обменник обладает относительно низким сродством к Са2+ и поэтому начинает действовать эффективно только при 10-кратном превышении нормального уровня Са2 +, что случается при многократной стимуляции мышечной или нервной клетки.
Кальциевый насос в мембранах специализированных органелл тоже играет важную роль в поддержании концентрации Са2+ в цитозоле на низком уровне: эта Са2 + -АТРаза способна закачивать в органеллы большие количества ионов кальция из цитозоля против крутого градиента концентрации даже тогда, когда их уровень в цитозоле низок. Ионы Са2 + хранятся в полости запасающей органеллы в состоянии непрочной ассоциации с Са2 +-связывающим белком кальсеквестрином, который обладает низким сродством к Са2+ (Кл = 103 л/моль), но высокой емкостью (~50 ионов Са2+ на молекулу). Если окрасить клетки антителами к кальсеквестрину и Са2 +-АТР-азе, то выявятся одни и те же ограниченные мембранами органеллы, меньшие по размерам и отличные от гранулярного эндоплазматического ретикулума (рис. 12-19). Эти органеллы гомологичны саркоплазматическому ретикулуму в мышечных клетках (разд. 11.1.11) и, подобно этому ретикулуму, специализированы для хранения и освобождения Са2 +. В дальнейшем мы будем называть их Са2+-запасающнми органеллами.
Обычно концентрация свободных ионов кальция в цитозоле варьирует в пределах примерно от 10-7 М во время покоя до 5- 10-б М при активации внешним сигналом. Но если клетка повреждена и не в состоянии эффективно откачивать ионы Са2+ из цитозоля, их концентрация может стать опасно высокой (> 10-5 М). В этих обстоятельствах начинает действовать высокоэффективный кальциевый насос с низким сродством во внутренней митохондриальной мембране, использующий энергию электрохимического градиента, который создается на этой мембране за счет энергии переноса электронов при окислительном фосфорилировании (разд. 7.1.8).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
12.3.8 Ион Са2 + действует как вездесущий внутриклеточный посредник [15]
Первые данные о роли иона Са2+ как внутриклеточного посредника были получены в 1947 г., когда выяснилось, что инъекция в клетку скелетной мышцы небольшого количества Са2+ вызывает ее сокращение. В последние годы стало ясно, что Са2+ служит внутриклеточным посредником в весьма разнообразных клеточных реакциях, включая секреторные процессы и пролиферацию. Были выявлены два типа передачи сигнала с участием ионов Са2+ (рис. 12-20), один из которых реализуется главным образом в электрически активных клетках, а другой - почти во всех клетках эукариот. Первый из этих путей был подробно исследован на нервных клетках, где деполяризация плазматической мембраны вызывает поглощение Са2+ нервным окончанием, инициируя секрецию нейромедиатора; Са2+ входит через потенциал-зависимые кальциевые каналы, которые открываются при деполяризации плазматической мембраны нервного окончания в момент прихода потенциала действия (разд.
19.3.2). При втором, повсеместно распространенном способе связывание сигнальной молекулы с рецептором клеточной поверхности ведет к освобождению Са2+ из внутриклеточных хранилищ; события на поверхности клетки сопряжены с открытием кальциевых каналов во внутриклеточной мембране с помощью другого внутриклеточного посредника-инозитолтрисфосфата. Он образуется в плазматической мембране в результате быстрого гидролиза минорных фосфолипидов (инозитолфосфолипидов).
хранилищ [16]
Предположение о роли инозитолфосфолипидов (фосфоинозитидов) в передаче сигнала впервые возникло в 1953 г., когда было обнаружено, что некоторые внеклеточные сигналы стимулируют включение радиоактив-

Рис. 12-20. Два главных пути, которыми Ca2+ может проникнуть в цитозоль, чтобы выполнить свою функцию внутриклеточного посредника для внеклеточных сигналов. В случае А кальций входит в нервное окончание из внеклеточной жидкости через потенциал-зависимые кальциевые каналы, когда мембрана нервного окончания деполяризуется потенциалом действия. В случае Б связывание внеклеточной сигнальной молекулы с поверхностным рецептором стимулирует выход Са2+ из его хранилищ внутри клетки.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-21. Инозитолфосфолипиды (фосфоинозитиды) в клетках млекопитающих составляют менее 10% всех фосфолипидов клеточной мембраны. Полифосфоинозитиды (PIP и Р1Р2)-продукты фосфорилирования фосфатидилинозитола (Р.). Хотя при воздействии внешнего сигнала могут расщепляться все три инозитолфосфолипида, наибольшую роль играет расщепление Р1Р2, хотя он составляет менее 10% общего количества инозитолфосфолипидов и менее 1% всех фосфолипидов клетки.
ного фосфата в фосфатидилинозитол (Р.) - минорный фосфолипид клеточной мембраны. Позднее было показано, что это включение обусловлено реакциями расщепления и ресинтеза инозитолфосфолипидов, запускаемыми рецептором, который активирует фермент фосфоинозитид-
специфическую фосфолипазу С. Из инозитолфосфолипидов наиболее важную роль в передаче сигнала играют два фосфорилированных производных PI -Р1-фосфат (PIP) и Р1-6исфосфат (Р1Р2), которые, как полагают, находятся главным образом во внутреннем листе липидного бислоя плазматической мембраны (рис. 12-21). Хотя Р1Р2 содержится в мембранах животных клеток в гораздо меньших количествах, чем PI, наибольшее значение имеет именно гидролиз Р1Р2.
Цепь событий, соединяющих внешний сигнал и внутренний ответ через гидролиз Р1Р2, начинается с присоединения сигнальной молекулы к ее рецептору в плазматической мембране. В настоящее время установлено, что гидролиз инозитолфосфолипидов участвует в передаче сигнала более чем от 25 различных рецепторов клеточной поверхности (табл. 12-4). Хотя детали этой активации менее ясны, чем в случае аденилатциклазы, накапливается все больше данных о том, что и здесь, в плазматической мембране, работает аналогичный многоступенчатый механизм. Вероятно, активированный рецептор активирует G-белок (пока условно названный Gp), а тот в свою очередь активирует фосфолипазу С.
Менее чем за секунду этот фермент превращает Р.Р2 в два продукта: инозитол-
| Таблица 12-4. Некоторые клеточные реакции, осуществляемые через фосфоинозитидный каскад. | ||
| Ткань-мишень | Сигнальная молекула | Главный ответ |
| Печень | Вазопрессин | Распад гликогена |
| Поджелудочная железа | Ацетилхолин | Секреция амилазы |
| Гладкая мускулатура | Ацетилхолин | Сокращение |
| ß-Клетки поджелудочной железы | Ацетилхолин | Секреция инсулина |
| Тучные клетки | Антиген | Секреция гистамина |
| Тромбоциты | Тромбин | Секреция серотонина и PDGF |
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
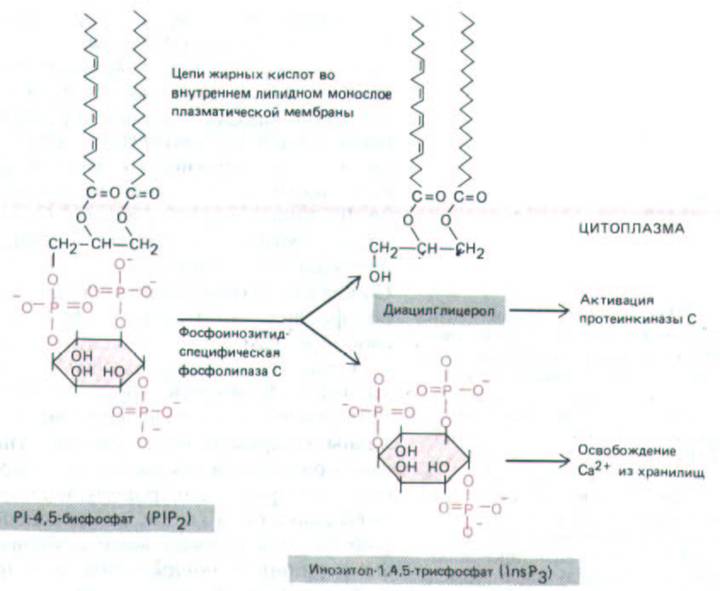
Рис. 12-22. При гидролизе Р1Р2 образуется инозитолтрисфосфат (InsP3), который диффундирует через цитозоль и освобождает Са2 + из Са2 +-запасающих органелл. Другой продукт гидролиза –диацил-глицерол - тоже играет важную роль во внутриклеточной передаче сигнала, активируя протеинкиназу С (см. ниже в тексте).
трисфосфат и диацилглицерол (рис. 12-22). Здесь путь передачи сигнала разделяется на две ветви. Поскольку обе названные молекулы играют важнейшую роль в последующем развитии ответа, мы рассмотрим их по отдельности.
Инозитолтрисфосфат (InsP3)-небольшая водорастворимая молекула, которая освобождает ионы Са2+ из их хранилищ внутри клетки (рис.
12-22). Когда lnsP3 добавляют к пермеабилизованным клеткам (мембрана которых путем специальной обработки сделана проницаемой) или к
выделенным внутриклеточным везикулам, он вызывает выход Са2 + в среду. Очевидно, связывание InsP3 с рецептором на цитоплазматической поверхности внутриклеточной органеллы открывает кальциевые каналы в ее мембране. Два механизма делают выброс кальция кратковременным:
1) ионы Са2 +, поступающие в цитозоль, быстро откачиваются оттуда, в основном за пределы клетки (позже, после удаления стимула, клетка постепенно восполнит свой запас Са2+, поглощая его через плазматическую мембрану); 2) часть InsP3 быстро дефосфорилируется (и тем самым инактивируется) специальной фосфатазой. Однако дефосфорилируется не весь InsP3: часть его, напротив, фосфорилируется до инозитол-1,3,4,5-
тетракисфосфата (InsP4), при участии которого в клетке, возможно, развиваются более медленные и продолжительные реакции. В некоторых клетках освобождение Са2+ происходит в виде серии «импульсов», каждый из которых длится 10 с или более.
12.3.10. Диацилглицерол, образующийся при гидролизе Р1Р2, активирует протеинкиназу С [17]
В то время как InsP3, образующийся при гидролизе Р1Р2, повышает концентрацию Са2+ в цитозоле, другой продукт расщепления Р1Р2-
диацилглицерол -производит совершенно другие эффекты. У него есть две потенциально «сигнальные» роли: он может распадаться дальше с образованием арахидоновой кислоты, необходимой для синтеза простагландинов и родственных им медиаторов липидной природы (см. рис. 12-8), или, что важнее, способен активировать специфическую про-
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
теинкиназу, которая затем фосфорилирует ряд белков с различными функциями в клетке-мишени.
Фермент, активируемый диацилглицеролом, называется протеннкнназой С или С-киназой, так как активность его зависит от Са2 +.
Диацил-глицерол - продукт активации рецептора - вместе с фосфолипидом внутреннего слоя плазматической мембраны фосфатидилсерином
присоединяются к протеинкиназе С, повышая ее сродство к Са2 + настолько, что она становится активной уже при низких концентрациях Са2 + в цитозоле. Во многих клетках, однако, С-киназа в норме активируется, вероятно, совместным воздействием диацилглицерола и ионов Са2 +, концентрация которых в цитозоле повышается под влиянием InsP3. Активация С-киназы кратковременна, так как через несколько секунд диацилгдицерол фосфорилируется до фосфатидной кислоты или расщепляется с высвобождением арахидоновой кислоты.
С-киназа, активированная диацилглицеролом и Са2 +, переносит концевую фосфатную группу с АТР на специфические сериновые или треониновые остатки белков-мишеней, которые в разных клетках различны. Например, во многих животных клетках С-киназа, по-видимому, фосфорилирует и тем самым активирует На+/Н+-обменник плазматической мембраны, контролирующий внутриклеточный рН (разд. 6.4.10);
повышение рН в клетке может способствовать пролиферации. Концентрации С-киназы выше всего в головном мозгу, где помимо прочего она фосфорилирует ионные каналы нейронов, изменяя таким образом их свойства и возбудимость клеток (разд. 19.5). В некоторых клетках активация С-киназы усиливает транскрипцию определенных генов. В промоторах по меньшей мере некоторых из этих генов есть общая энхансерная последовательность, узнаваемая регуляторним белком, активность которого растет при активации С-киназы (см. табл. 10-1). Пока, однако, остается невыясненным, как С-киназа активирует этот белок - фосфорилируя (и соответственно активируя) его прямо или же действуя косвенно, через каскад протеинкиназ.
Каждый из двух путей фосфоинозитидного сигнала можно имитировать, добавляя к иyтактным клеткам подходящий фармакологический агент. Эффекты InsP3 имитируются кальциевыми ионофорами, такими как А23187 или иономицин, которые позволяют ионам Са2+ входить в цитозоль из внеклеточного пространства (разд. 6.4.19). Действие

Рис. 12-23. Две ветви инозитолфос-фолипидного пути. Как полагают, активированный рецептор связывается со специфическим G-белком (Gp), заставляя его α-субъединицу диссоциировать и активировать фосфолипазу С, которая расщепляет Р1Р2 с образованием InsP3 и диацилглицерола. Истинная структура белка до сих пор не ясна. Диациглицерол (при участии не показанных на схеме связанных ионов Са2+ и фосфатидилсерина) активирует С-киназу. Оба фермента и фосфолипаза С, и С-киназа-присутствуют в клетках как в растворимой, так и в мембраносвязанной форме; в процессе активации одна из них или обе они перемещаются из цитозоля на внутреннюю поверхность плазматической мембраны. Эффект InsP3 можно имитировать экспериментально на интактных клетках обработкой Са2+-ионофором, а эффект диацилглицерола-
обработкой моноацилпроизводными диацилглицерола или форбодовыми зфирами, которые связываются с С-киназой и активируют ее.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
диацилглицерола может быть имитировано моноацильными производными диацилглицерола или форболовыми эфирами - веществами растительного происхождения, которые присоединяются к С-киназе и непосредственно активируют ее (рис. 12-23). С помощью этих реагентов было показано, что часто для получения полноценного клеточного ответа обе ветви должны действовать совместно. Например, пролиферацию клеток многих типов в культуре можно стимулировать, одновременно применяя кальциевый ионофор и активатор С-киназы, тогда как поодиночке эти реагенты неэффективны.
Когда по какой-то причине клетки начинают чрезмерно размножаться, это, разумеется, привлекает к себе внимание. Именно поэтому влияние форболовых эфиров на клеточную пролиферацию впервые было открыто благодаря их действию как «опухолевых промоторов» в организме животных. Опухолевые промоторы - это вещества, которые сами по себе рака не вызывают, но могут индуцировать опухолевый рост у животного после воздействия небольшой дозы канцерогена, недостаточной, чтобы вызвать рак. Когда позднее оказалось, что форболовые эфиры непосредственно активируют С-киназу, это помогло выяснить один из внутриклеточных механизмов реакции клеток на ростовые сигналы. Вообще фундаментальные исследования причин рака, и в особенности онкогенных вирусов животных, дали немало ценных сведений о путях передачи сигналов внутри клеток.
12.3.11. Так называемые ras -онкогены кодируют новый класс G-белков, участвующих в регуляции клеточного
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1127; Нарушение авторских прав?; Мы поможем в написании вашей работы!