
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Активаторы G-белков образуют большое семейство гомологичных гликопротеинов, семикратно
|
|
|
|
пронизывающих мембрану [19]
Сигнальные системы, в которых используются G-белки, удивительно многообразны. Мы видели, что некоторые G-белки (Gs и Gi)
сопрягают рецепторы с аденилатциклазой, а другие (Gp) с фосфолипазой С. В глазу позвоночных G-белок, называемый трансдуцином, сопрягает поглощение фотона молекулой родопсина с активацией фермента фосфодиэстеразы, который гидролизует cGMP (разд. 12.4.5); падение концентрации этого внутриклеточного посредника приводит к электрическим изменениям в клетке-фоторецепторе. Все эти G-белки могут опосредованно, тем или иным способом изменять состояние ионных каналов, однако некоторые G-белки могут взаимодействовать с ними непосредственно. Например, присоединение ацетилхолина к рецепторам на клетках сердечной мышцы активирует Gi-подобный белок, который прямо активирует калиевый канал в плазматической мембране. (Эти рецепторы, чувствительные к алкалоиду мухомора мускарину, называют мускаринивыми рецепторами ацетилхолина в отличие от других - никотиновых рецепторов ацетилхолина, которые являются каналообразующими рецепторами скелетных мышц-см. разд. 6.4.17.)
Все до сих пор охарактеризованные G-белки, которые работают в этих столь различных системах, эволюционно родственны. Они имеют сходную субъединичную структуру и аминокислотную последовательность: у. -субъединицы трансдуцина и Gi, например, последовательности на 65% идентичны. Не удивительно, что многие, если не все, взаимодействующие с этими G-белками рецепторы тоже гомологичны между собой, что стало ясно после секвенирования их кДНК. Обобщение первичных структур рецепторов этого быстро растущего класса дало общую структуру, состоящую из одной полипептидной цепи, которая пронизывает липидный бислой семь раз. Это семейство семикратно трансмембранных белков-
рецепторов включает β-адренэргические рецепторы (рис. 12-24), мускариновые рецепторы для ацетилхолина, несколько рецепторов для нейропептидов и даже родопсин. Похоже, что все эти гликопротеины входят в очень большое семейство эволюционно родственных рецепторов.
Общий структурный «мотив», вероятно, возник в эволюции рано, так как он свойствен уже бактериородопсину (светочувствительному протонному насосу, который, правда, действует не через G-белок - см. разд. 6.27) и рецепторным белкам, участвующим в регуляции созревания дрожжей (разд.
10.3.2). Однако не все рецепторы клеточной поверхности несколько раз пронизывают мембрану, и сейчас мы переходим к другому классу рецепторов - к семейству тирозин-специфических протеинкиназ.
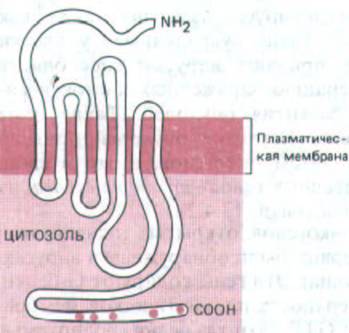
Рис. 12-24. Схема предполагаемого расположения β-адренэргического рецептора в плазматической мембране. Выделенные красным цветом участки цитоплазматического «хвоста» указывают положение остатков серина-потенциальных мишеней для фосфорилирования при десенсибилизации рецептора (разд. 15.5.2). Установлено, что у других рецепторов, сопряженных с G-белками, полипептидная цепь тоже семикратно пронизывает мембрану. (По данным R. A. Dixon et al., Nature 321: 75-79, 1986.)
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
12.3.13. Многие каталитические рецепторы – гликопротеины с тирозин-специфической протеинкиназной
активностью, однократно пронизывающие мембрану [20]
Обширная группа поверхностных рецепторов трансформирует внешний сигнал во внутриклеточный с помощью G-белков, но есть и такие рецепторы, которые действуют более коротким путем. Это каталитические белки-рецепторы, и наиболее изученные среди них - однократно пронизывающие мембрану тирозин-специфические протеинкиназы, каталитический домен которых находится с внутренней стороны плазматической мембраны. При связывании лиганда они активируются и переносят терминальную фосфатную группу от АТР на гидроксильную группу тирозинового остатка в определенных белках клетки-мишени. К этому семейству протеинкиназ относятся рецепторы инсулина, многих ростовых факторов, включая тромбоцитарный фактор роста (ТФР, или PDGF - platelet-derived growth factor, см. разд. 13.3.4) и фактор роста эпидермиса (ФРЭ, или EGP - epidermal growth factor), который стимулирует деление эпидермальных и многих других клеток (см. рис. 12-25).
Большинство других протеинкиназ фосфорилирует сериновые или, реже, треониновые остатки в белках, так что фосфотирозин содержится менее чем в 0,1% фосфорилированных белков клетки. Во всех изученных случаях белок-рецептор с тирозинкиназной активностью фосфорилирует и сам себя, когда активирован. В случае рецептора инсулина это самофосфорилирование повышает активность киназы по типу положительной обратной связи.
Каким образом связывание лиганда с внеклеточным доменом рецептора активирует каталитический домен на другой стороне плазматической мембраны? Трудно представить себе, как конформационные изменения могли бы передаваться через липидный бислой по одиночной трансмембранной α-спирали. В случае рецептора для EGF связывание лиганда вызывает конформационные изменения наружного домена, что приводит к димеризации рецептора. Возможно, что в результате взаимодействия двух соседних цитоплазматических доменов димер приобретает каталитическую активность.
Имеется достаточно данных о том, что важную роль в сигнальном процессе играет киназная функция рецепторов. Например, клетки, содержащие мутантный рецептор инсулина с единственной аминокислотной заменой, избирательно подавляющей киназную активность, на инсулин не реагируют. Однако идентифицировать ключевые субстраты, которые фосфорилируются наряду с самим рецептором, чрезвычайно трудно, и поэтому конкретная роль фосфорилирования тирозина в передаче сигнала остается неясной. В случае рецептора для PDGF одним из субстратов, по-видимому, является киназа, фосфорилирующая фосфатидилинозитол (PI-киназа, см. рис. 12-21). Возможно, этим объясняется тот парадоксальный факт, что PDGF вызывает медленную активацию фосфоинозитидного сигнального пути, хотя его рецептор не сопряжен с Gp 1.
После связывания лиганда многие каталитические рецепторы переходят внутрь клетки путем эндоцитоза в окаймленных пузырьках, содержащих комплексы рецептор-лиганд (разд. 6.5.7). В некоторых случаях такой эндоцитоз, по-видимому, определяется самофосфорилированием рецептора. Этот процесс может играть важную роль и в расщеплении сигнальных молекул, и в регуляции плотности рецепторов на поверх-
_____________
1 В последнее время появились данные, что рецепторы по крайней мере некоторых факторов роста после связывания лиганда могут фосфорилировать и фосфолипазу С, усиливая гидролиз Р1В2.-Прим. перев.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ности клетки-мишени (разд. 12.5). Кроме того, происходящий при этом перенос домена с тирозинкиназной активностью в новый участок клетки тоже может быть существенным для сигнального процесса, хотя это пока еще не доказано.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!