
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Концентрация какого-либо вещества может быстро изменяться лишь в том случае, если оно имеет короткое
|
|
|
|
12-25
время жизни [29]
Если для клетки важно очень быстро изменять концентрацию каких-либо молекул (например, с AMP или Са2+), то эти молекулы должны непрерывно разрушаться или быстро удаляться каким-нибудь иным способом - другими словами, подвергаться быстрому обновлению. Рассмотрим, например, два внутриклеточных вещества X и Y, каждое из которых обычно представлено в клетке тысячей молекул. Пусть X имеет низкую оборачиваемость - каждую секунду разрушается и синтезируется 10 молекул X; таким образом, среднее время жизни молекулы в клетке 100 с.
Скорость синтеза и распада Y в 10 раз больше, т.е. 100 молекул в секунду, и соответственно время жизни молекулы Y равно 10 с. Если
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-33. Сопряжение поверхностных рецепторов с активацией аденилатциклазы через G-белок позволяет не только преобразовывать внеклеточный сигнал во внутриклеточный, но и многократно его усиливать. Такого же рода усиление происходит при активации инозитолфосфолипидного пути. На первом этапе усиления для активации множества молекул GS-белка вовсе не обязательно длительное связывание сигнального лиганда с рецептором (см. разд. 12.3.5).
скорость синтеза обоих веществ увеличится в 10 раз, а скорость разрушения останется неизменной, то спустя 1 с число молекул Y в клетке возрастет почти на 900 (10-100 — 100), а число молекул Х-всего лишь на 90. В общем случае время, за которое концентрация каких-либо молекул пройдет половину пути от прежней равновесной концентрации до новой после ускорения или замедления их синтеза, равно обычному времени полужизни этих молекул - времени, за которое концентрация их уменьшилась бы вдвое, если бы их синтез прекратился (рис. 12-34).
Этот принцип справедлив как для малых молекул, так и для белков, как для внутриклеточных, так и для внеклеточных веществ. Время полужизни многих внутриклеточных белков, подвергающихся быстрому расщеплению или ковалентной модификации, составляет 2 ч и меньше, а у некоторых оно не превышает 10 мин. В большинстве случаев это белки с ключевыми регуляторними функциями, и концентрация их в клетке легко контролируется изменением скорости их синтеза.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
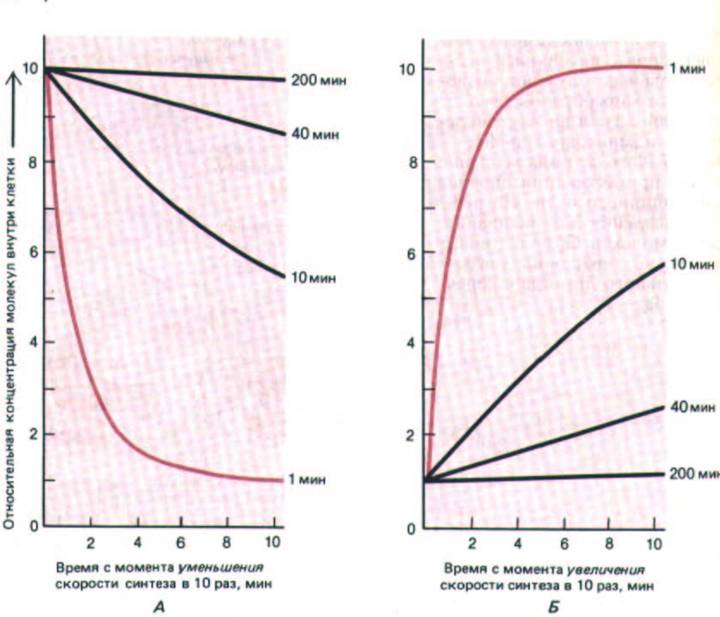
Рис. 12-34. Относительная скорость изменения внутриклеточной концентрации молекул с различным временем полуобновления при уменьшении (А) или увеличении (Б) скорости их синтеза в 10 раз (теоретические кривые). В обоих случаях концентрация молекул, быстро разрушающихся в клетке (цветные линии), изменяется быстро, а концентрация молекул с большими периодами полуобновления - пропорционально более медленно. Цветные цифры справа - время полужизни различных молекул.
12.4.8. Клетки могут резко отвечать на плавное повышение концентрации внеклеточного сигнала [30]
Некоторые реакции клеток на сигнальные молекулы бывают плавными (градуальными) и усиливаются прямо пропорционально увеличению концентрации лиганда. Таковы обычно первичные ответы клеток на стероидные гормоны, вероятно потому, что каждый рецепторный белок связывает одну молекулу гормона, а каждая специфическая узнаваемая последовательность ДНК в гормоночувствительном гене действует независимо (разд. 12.2.1). С повышением концентрации гормона пропорционально возрастает концентрация гормон-рецепторных комплексов, а значит, и число этих комплексов, присоединившихся к специфическим участкам генома. Клеточный ответ в этом случае будет градуальным и линейным.
Однако другие реакции клеток на увеличение концентрации сигнальных молекул могут начинаться более резко, а некоторые - даже практически по типу «всё или ничего». В последнем случае не наблюдается никакого ответа до тех пор, пока концентрация лиганда не достигнет определенного порогового уровня, а после достижения этого уровня сразу развивается максимальная реакция. Например, некоторые факторы роста действуют как сигналы типа «всё или ничего», заставляя клетку приступить к репликации ДНК, предшествующей клеточному делению. Каковы могут быть молекулярные основы такого резкого или даже внезапного ответа на плавно изменяющийся сигнал?
Один из возможных механизмов основан на принципе кооперативности, когда для активации какой-то макромолекулы-мишени необходимо присоединение к ней двух или нескольких внутриклеточных эффекторов (или их комплексов с рецептором). Например, при некоторых реакциях на стероидные гормоны для активации надлежащего гена, по-видимому, требуется одновременное связывание со специфическим участком хроматина нескольких гормон-рецепторных комплексов. В результате при увеличении концентрации гормона ген активируется более резко, чем если бы для его активации было достаточно одного такого комплекса
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
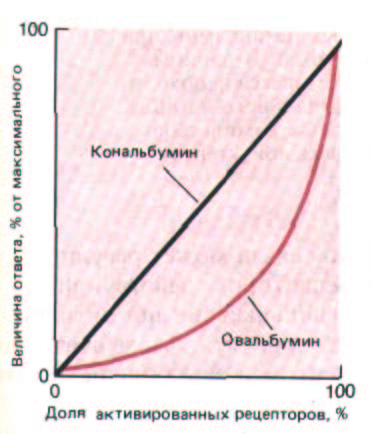
Рис. 12-35. Наблюдаемый ответ клеток куриного яйцевода на стероидный гормон эстрадиол. Активированные рецепторы эстрадиола переходят в ядро и включают транскрипцию нескольких генов. Показана зависимость реакции от доли активированных рецепторов для двух из этих генов, кодирующих белки яйца - кональбумин и оваль бумин. Линейная зависимость для кональбумина указывает на то, что ген этого белка включается одной молекулой активированного рецептора. Напротив, замедленное начало синтеза овальбумина с последующим крутым подъемом кривой означает, что для запуска транскрипции овальбуминового гена, вероятно, необходимо присоединение к нему более одной молекулы активированного рецептора (в данном случае двух молекул). (Из Е. R. Mulvihill, R. D. Palmiter, J. Biol. Chem. 252: 2060-2068, 1977, с изменениями.)
(рис. 12-35). Аналогичный механизм кооперативности действует при активации с участием А-киназы и кальмодулина; поскольку кальмодулин принимает активирующую конформацию только тогда, когда он свяжет два или больше ионов Са2+ (см. рис. 12-30), повышение внутриклеточной концентрации этих ионов всего лишь в 10 раз вызывает уже 50-кратное усиление активации. Такие кооперативные реакции становятся тем более резкими, чем больше молекул-эффекторов нужно для активации молекулы-мишени, и если их число становится достаточно большим, то дело может дойти до реакции типа «всё или ничего» (рис. 12-36 и 12-37).
Ответы становятся намного более резкими и в том случае, если лиганд активирует один фермент и одновременно подавляет активность другого, катализирующего обратную реакцию. Мы уже рассмотрели один пример такого регуляторного принципа, когда говорили о стимуляции распада гликогена в мышечных клетках, где повышение уровня сАМР одновременно активирует киназу фосфорилазы и ингибирует фосфопротеинфосфатазу, действующую в противоположном направлении (разд. 12.4.1, 12.4.2).
Другая возможная причина реакции типа «всё или ничего» на постепенное повышение концентрации сигнального лиганда - механизм положительной обратной связи. С помощью этого механизма нервные и мышечные клетки генерируют по принципу «всё или ничего» потенциалы
действия при связывании нейромедиаторов. Например, при активации ацетилхолиновых рецепторов нервно-мышечного соединения в плазматической мембране мышечной клетки открываются каналы для катионов, и переходящие внутрь клетки ионы Na + вызывают местную деполяризацию мембраны. Если эта деполяризация достигает определенного порогового уровня, в том же участке мембраны открываются потенциалзависимые натриевые каналы, что приводит к дальнейшему притоку натрия; в результате деполяризация усиливается, это приводит к открытию еще большего числа натриевых каналов и т. д. Так возникает потенциал действия, который распространяется по всей мембране мышечной клетки.
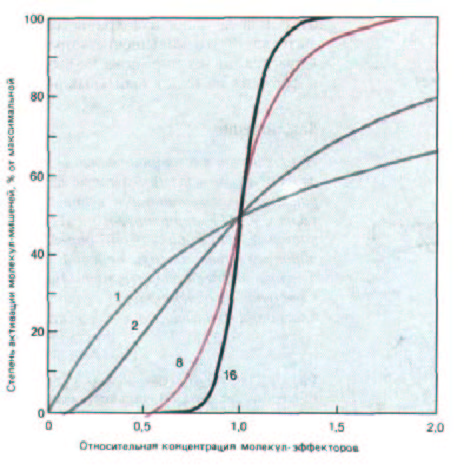
Рис. 12-36. Как видно из этого графика, кривые с крутым подъемом типа «всё или ничего» получаются в тех случаях, когда для активации макромолекулы-мишени необходимо присоединение к ней нескольких молекул-эффекторов. Приведены теоретические кривые для случаев активации при одновременном связывании различного числа (1, 2, 8 и 16) зффекторных молекул.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-37. Схема одного из возможных сигнальных механизмов, при котором следует ожидать реакции с резким порогом. В данном примере для образования активного белкового комплекса необходимо одновременное связывание восьми молекул сигнального лиганда. При низких концентрациях лиганда число активных комплексов будет возрастать пропорционально примерно восьмой степени концентрации.
Такой механизм положительной обратной связи может регулировать работу не только ионных каналов, но и рецепторов, действующих как ферменты. Представим себе, что некий сигнальный лиганд активирует фермент и что две или больше молекул продукта ферментативной реакции вновь связываются с тем же ферментом и еще больше активируют его (рис. 12-38). Количество продукта такого фермента будет расти очень медленно, пока концентрация активирующего лиганда не достигнет пороговой величины, при которой накопится достаточно продукта, чтобы вызвать самоускоряютщуюся активацию фермента. В этот момент концентрация продукта начнет резко возрастать. Благодаря такому механизму клетка может отвечать на постепенное изменение концентрации сигнального лиганда скачкообразным изменением количества определенного метаболита.
Механизм, проиллюстрированный на рис. 12-38, в принципе относительно прост, но он имеет важную особенность, которая делает его непригодным для одних целей и чрезвычайно ценным для других, Если такая система была «включена» в результате достаточного повышения концентрации сигнального лиганда, то она, как правило, продолжает находиться в этом состоянии даже тогда, когда сигнал падает ниже порогового уровня: вместо того чтобы все время отражать текущую величину сигнала, система обнаруживает своего рода «память». В качестве примера можно привести Са2+/кальмодулин-регулируемую полифункциональную протеинкиназу (разд. 12.4.3), которая, видимо, работает как активируемый ионами Са2+ молекулярный переключатель. При активации комплексами Са2+/кальмодулин эта киназа помимо других клеточных белков фосфорилирует также и сама себя. В результате такого самофосфорилирования ее активность становится независимой от ионов кальция и сохраняется на повышенном уровне дольше, чем вызвавший это повышение кальцевый сигнал. Такое состояние поддерживается до тех пор, пока не возрастет активность клеточных фосфатаз и фермент не будет ими «выключен».
Заключение
Непрерывное и быстрое удаление из клетки свободных ионов Са2+ и сАМР делает возможными быстрые изменения концентраций этих
двух внутриклеточных медиаторов в ответ на внеклеточные сигналы. Повышение уровня сАМР активирует сАМР-зависимые протеинкиназы (А-
киназы), которые фосфорилируют определенные белки-мишени. Этот эффект обратим, так как при падении уровня сАМР фосфорилированные
белки быстро дефосфорилируются. Аналогичным образом, повышение внутриклеточной концентрации свободных ионов кальция влияет на клетки
благодаря связыванию Са2+ с кальмодулином, который при этом изме-

Рис. 12-38. Схема механизма с «ускоряющей положительной обратной связью». Начальное связывание сигнального лиганда активирует фермент, а затем продукт ферментативной реакции связывается с самим ферментом, еще больше повышая его активность.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
няет свою конформацию; комплекс Са2+/кальмодулин активирует много различных белков-мишеней, в том числе Са2+ /кальмодулин-зависимые
протеинкиназы (Сa2 + -киназы). Клетки каждого типа имеют свой характерный набор таких белков-мишеней, поэтому изменение уровня сАМР и
Са2+ вызывает в клетках разного типа различные, характерные для каждого типа реакции. Использование с AMP и Са2 + в качестве вторичных
посредников позволяет во много раз усиливать реакцию на внеклеточный сигнал и регулировать ее разнообразными способами.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 584; Нарушение авторских прав?; Мы поможем в написании вашей работы!