
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Использование вторичных посредников и ферментных каскадов позволяет в огромной степени усиливать
|
|
|
|
12-16
12-22
12-21
12.4.1. с AMP активирует сАМР-зависимую протеинкиназу [23]
В животных клетках сАМР действует главным образом путем активации специфического фермента, называемого сАМР-зависимой
протеинкиназой (А-киназой). Этот фермент катализирует перенос концевого фосфата с АТР на определенные остатки серина и треонина в некоторых белках клетки-мишени. Остатки, фосфорилируемые А-киназой, отличаются тем, что со стороны N-конца около них расположены две или большее число основных аминокислот. Ковалентне. фосфорилирование таких остатков в свою очередь регулирует активность этих белков.
Впервые сАМР-зависимое фосфорилирование белков было выявлено при изучении метаболизма гликогена в клетках скелетных мышц.
Гликоген - это основная резервная форма глюкозы; как уже упоминалось, его распад в мышечных клетках регулируется адреналином (фактически адреналин регулирует как распад гликогена, так и его синтез в скелетной мускулатуре). Если, например, животное подвергнуть стрессу (испугать и т. п.), то надпочечники начнут выбрасывать адреналин в кровь, и это будет приводить различные ткани организма в состояние «готовности».
Циркулирующий в крови адреналин вызывает, в частности, расщепление гликогена в мышечных клетках до глюкозо-1-фосфата и в то же время подавляет синтез нового гликогена. Глюкозо-1-фосфат превращается в глюкозо-6-фосфат, который затем окисляется в реакциях гликолиза с образованием АТР, обеспечивая энергию для интенсивной работы мышц. Таким способом адреналин подготавливает мышечные клетки к усиленной работе.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-26. На этой схеме показано, как повышение уровня сАМР в клетках скелетных мышц (при связывании адреналина с β-
адренэргическими рецепторами клеточной поверхности) стимулирует распад гликогена. Связывание сАМР с А-киназой активирует этот фермент, который в свою очередь фосфорилирует и тем самым активирует киназу фосфорилазы, а она фосфорилирует (и активирует) гликогенфосфорилазу -
фермент, расщепляющий гликоген. А-киназа также прямо и опосредованно усиливает фосфорилирование гликогенсинтетазы (которая при этом ингибируется), и это ведет к прекращению синтеза гликогена (не показано).
Как уже говорилось, на поверхности мышечных клеток адреналин связывается с β -адренэргическими рецепторами, что ведет к активации аденилатциклазы и повышению уровня сАМР в цитозоле. сАМР активирует А-киназу, и она фосфорилирует другой фермент -киназу фосфорилазы
(первую протеинкиназу, которую удалось получить в очищенном виде в 1959 г.). Эта последняя в свою очередь фосфорилирует (и тем самым активирует) гликогенфосфорилазу, отщепляющую остатки глюкозы от молекулы гликогена (рис. 12-26). Активированная А-киназа, кроме того, усиливает фосфорилирование гликогенсинтазы - фермента, осуществляющего последний этап синтеза гликогена из глюкозы, фосфорилирование инактивирует гликогенсинтазу и прекращает синтез гликогена. С помощью такого каскада взаимодействий повышение уровня сАМР приводит одновременно как к уменьшению синтеза гликогена, так и к усилению его распада, что максимально увеличивает количество глюкозы, доступной для использования клеткой.
В некоторых животных клетках повышение уровня сАМР активирует транскрипцию специфических генов. В нейроэндокринных клетках гипоталамуса (разд. 12.1.2), например, сАМР «включает» ген, кодирующий пептидный гормон соматостатин. В промоторной области гена соматостатина есть короткая последовательность ДНК (около 30 нуклеотидов), найденная также в промоторах ряда других генов, активируемых сАМР. Эта последовательность узнается специфическим регуляторным белком, который, будучи фосфорилирован А-киназой, активирует транскрипцию этих генов.
В неактивном состоянии А-киназа - это комплекс из двух регуляторных субъединиц, связывающих сАМР, и двух каталитических субъединиц. Связывание сАМР изменяет конформацию регуляторных субъединиц, что приводит к отделению их от комплекса. Освобожденные каталитические субъединицы и представляют собой активную А-киназу; они фосфорилируют молекулы белков-субстратов (рис. 12-27).
А-киназа имеется во всех животных клетках, и полагают, что почти все эффекты, вызываемые сАМР, реализуются благодаря ей. Хотя
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.

Рис. 12-27. Активация сАМР-зависимой протеинкиназы (А-киназы). Присоединение сАМР к регуляторным субъединицам фермента вызывает изменение их конформации, приводящее к отделению этих субъединиц от комплекса. Освобождаемые при этом каталитические субъединицы активируются. Каждая регуляторная субъединица имеет два участка для связывания сАМР, и освобождение каталитических субъединиц представляет собой кооперативный процесс, требующий присоединения более чем двух молекул сАМР на тетрамер. Это делает реакцию киназы на изменение концентрации сАМР значительно более резкой (см. разд. 12.4.8). Во многих клетках имеются А-киназы двух типов-с одинаковыми каталитическими субъединицами, но разными регуляторними.
большинство ее белков-субстратов еще не охарактеризовано, ясно, что многие из них в клетках разных типов различны, и это позволяет понять, почему сАМР неодинаково влияет на разные клетки-мишени.
12.4.2. сАМР ингибирует внутриклеточную протеинфосфатазу [24]
Так как эффекты сАМР обычно непродолжительны, ясно, что клетка способна дефосфорилировать белки, фосфорилированные А-
киназой. Отщепление фосфата катализируют две главные протеинфосфатазы, одна из которых сама регулируется циклическим AMP. Уровень фосфорилирования всегда будет зависеть от баланса между активностями киназ и фосфатаз.
В клетках скелетных мышц с AMP-регулируемая протеинфосфатаза наиболее активна в отсутствие сАМР, и она дефосфорилирует все три ключевых фермента метаболизма гликогена, которые уже упоминались ранее, - киназу фосфорилазы, гликогенфосфорилазу и гликогенсинтазу.
Это дефосфорилирование противодействует фосфорилированию белков под действием сАМР. Однако А-киназа в активном состоянии фосфори-

Рис. 12-28. Циклический AMP ингибирует протеинфосфатазу, которая в активном состоянии противодействовала бы реакциям фосфорилирования, запускаемым сАМР. Он активирует А-киназу, а она фосфорилирует белок-ингибитор, который после этого присоединяется к протеинфосфатазе и подавляет ее активность.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
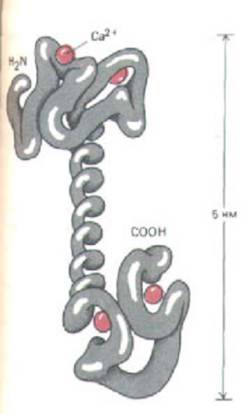
Рис. 12-29. Структура кальмодули-на (по данным рентгеноструктурного анализа). Молекула имеет форму гантели с двумя глобулярными юнцами, соединенными длинной открытой α-спиральго. Каждый конец имеет два Са2+-связывающих домена, представляющих собой петли из 12
аминокислотных остатков, в которых боковые цепи аспартата и глутамата образуют ионные связи с Са2 +. У двух участков связывания ионов кальция в С-концевой части молекулы сродство к ним в десять раз больше, чем в N-концевой части. (По данным Y. S. Babu et al., Nature 315: 37-40, 1985.)
лирует и тем самым активирует также специальный белок - ингибитор фосфатази. Этот белок присоединяется к фосфопротеинфосфатазе и инактивирует ее (рис. 12-28). Таким образом, А-киназа, активируя киназу фосфорилазы и одновременно подавляя активность фосфопро-
теинфосфатазы, намного усиливает и ускоряет воздействие повышенного уровня сАМР на синтез и распад гликогена по сравнению с тем, что было бы, если бы А-киназа действовала лишь на один из этих ферментов.
12.4.3. Кальмодулин является вездесущим внутриклеточным рецептором для ионов кальция [25]
Поскольку концентрация свободных ионов Са2 + в цитозоле обычно составляет около 10-7 М и, как правило, не поднимается выше 5 • 10-б М даже при поступлении их извне, любая структура клетки, чтобы быть непосредственной мишенью кальциевой регуляции, должна иметь константу сродства к Са2+ (Ка) порядка 106 л/моль. Если же учесть, что концентрация свободных ионов Mg2+ в цитозоле относительно постоянна и составляет около 10-3 М, то связывающие кальций центры должны обладать по меньшей мере 1000-кратной избирательностью к Са2+ по сравнению с Mg2+. Этим требованиям удовлетворяют несколько специфических Са2+-связывающих белков.
Первым из этих белков был открыт тропонин С в клетках скелетных мышц; роль его в мышечном сокращении обсуждалась в гл. 11 (разд.
11.1.12). Другой, близко родственный ему кальций-связывающий белок-кальмодулин - обнаружен во всех до сих пор изученных клетках животных и растений. Типичная животная клетка содержит более 107 молекул кальмодулина, что может составлять до 1% всего клеточного белка.
Кальмодулин функционирует как многоцелевой внутриклеточный рецептор для Са2 +, участвующий в большинстве процессов, регулируемых этими ионами. Это очень консервативный одиночный полипептид примерно из 150 аминокислот, имеющий четыре высокоаффинных Са2 +-
связывающих центра; при связывании кальция он претерпевает большие конформационные изменения (рис. 12-29).
Аллостерическая активация кальмодулина кальцием аналогична активации А-киназы циклическим AMP, с тем отличием что комплекс Са2+-кальмрдулин сам по себе не обладает ферментативной активностью и действует, связываясь с другими белками. В некоторых случаях кальмодулин служит постоянной регуляторной субъединицей ферментного комплекса (как в случае киназы фосфорилазы, см. ниже), но чаще

Рис. 12-30. Здесь показано, каким образом повышение концентрации свободных ионов Са2+ в цитозоле может косвенным образом активировать фермент, изменяя конформацию молекул кальмодулина. Подобно связыванию сАМР с А-киназой, связывание Са2+ с калъмо-дулином кооперативно: для активации этого белка требуется больше одного иона Са2 + (см. разд. 12.4.8).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
всего связывание Са2 + ведет к присоединению кальмодулина к различным белкам-мишеням и, как следствие, к изменению их активности (рис. 12-
30).
К числу мишеней, регулируемых комплексом Са2 +-кальмодулин, относится много ферментов и мембранных транспортных белков. Среди них выделяются Са2+/кальмодулин-зависимые протеинкиназы (Са-киназы), фосфорилирующие белки по остаткам серина и треонина. Первые из открытых Са-киназ - киназа легких цепей миозина и киназа фосфорилазы - имели узкую субстратную специфичность. Позже была идентифицирована широкоспецифичная Са-киназа, называемая Са2+/калъмодулин-регулируемой «полифункциональной» киназой (или Са-киназой
II); она может служить посредником во многих эффектах Са2+ в клетках млекопитающих. Как и в случае сАМР, ответ клетки-мишени на повышение концентрации свободного Са2+ в цитозоле определяется тем, какие Са2+/кальмодулин-регулируемые белки имеются в клетке.
12.4.4. Пути с участием сАМР и Са2+ взаимодействуют между собой [26]
Пути с участием вторичных посредников сАМР и Са2+ взаимодействуют по крайней мере тремя способами. Во-первых, внутриклеточные уровни Са2+ и сАМР влияют друг на друга. Например, комплексы Са2+/кальмодулин связываются с ферментами, которые разрушают или синтезируют сАМР,-с сАМР-фосфодиэстеразой и аденилатциклазой соответственно - и регулируют их активность; а в свою очередь А-киназа способна фосфорилировать некоторые кальциевые каналы и насосы и изменять их активность. Во-вторых, некоторые Са-киназы фосфорилируются А-киназой. В-третьих, А-киназа и Са-киназы нередко фосфорилируют различные участки одного белка, который, таким образом, регулируется сразу и циклическим AMP, и ионами Са2 +.
В качестве примера взаимодействия путей Са2 + и сАМР рассмотрим киназу фосфорилазы скелетных мышц, роль которой в расщеплении гликогена мы уже обсуждали. Эта киназа фосфорилирует гликогенфосфорилазу, расщепляющую гликоген (см. рис. 12-26). Киназа фосфорилазы -
мультисубъединичный фермент, но только одна из его четырех субъединиц фактически катализирует фосфорилирование: три другие -
регуляторные и дают комплексу возможность активироваться и циклическим AMP, и ионами кальция. Каждая из четырех субъединиц, обозначаемых α, β, γ и δ, представлена в комплексе четырьмя копиями. γ-Субъединица осуществляет катализ; чувствительность фермента к Са2+
определяется в основном δ -субъединицей-кальмодулином; субъединицы же α и β - мишени для сАМР-зависимой регуляции; обе они фосфорилируются А-киназой (рис. 12-31).
Тот же Са2 +-сигнал, который инициирует мышечное сокращение, обеспечивает и достаточный для этого источник энергии в виде глюкозы. Массированный выброс в цитозоль ионов Са2 + из саркоплазматического ретикулума, вызывающий сокращение миофибрилл (разд.
11.1.11), одновременно повышает активность киназы фосфорилазы, изменяя конформацию ее δ -субъединицы, и в результате скорость расщепления гликогена за несколько секунд увеличивается в сотни раз. Кроме того, выброс Са2 ' активирует две Са-киназы, которые фосфорилируют и ингибируют гликогенсинтазу, прекращая синтез гликогена. Рассмотренная выше цепь реакций фосфорилирования, запускаемая в мышечных клетках адреналином, заранее приспосабливает их метаболизм к повышенным энергозатратам; так, например, фосфорилирование киназы фосфорилазы А-киназой делает ее более чувствительной к Са2 + -для актива-

Рис. 12-31. Сильно схематизированное изображение четырех субъединиц киназы фосфорилазы из мышц млекопитающих.
Каталитической активностью обладает γ-субъединица; α- и β-субъединицы участвуют в регуляции этой активности циклическим AMP, а δ-
субъединица (кальмодулин)-в ее регуляции ионами Са2 +. В действительности полный ферментный комплекс содержит по четыре копии каждой субъединицы.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
ции требуется теперь меньшее число ионов кальция, связанных с кальмоду лином.
Используя двумерный гель-электрофорез, в эукариотических клетках удается выявить сотни различных фосфорилированных белков.
Лишь малая их часть фосфорилируется известными киназами, большинство же киназ еще ждет своего открытия. Действительно, по оценкам, одна клетка млекопитающего может содержать более 100 различных протеинкиназ, регулирующих мириады внутриклеточных реакций. Помимо фосфорилирования существует и много других обратимых ковалентных модификаций, регулирующих активность белков, например метилирование - деметилирование, ацетилирование - деацетилирование, уридилирование-деуридилирование, аденилирование-деаденилирование. Кажется вероятным, что активность большинства клеточных белков, катализирующих протекание скорость-лимитирующих этапов в биологических процессах, регулируется с помощью той или иной из этих модификаций. Если же учесть, насколько сложны могут быть обратные связи в одном только метаболизме гликогена, станет ясно, что раскрытие механизмов этих важных регуляторных процессов представляет собой сложную задачу.
12.4.5. cGMP тоже служит внутриклеточным посредником [27]
сАМР - не единственный циклический нуклеотид, используемый для внутриклеточной сигнализации. Большинство животных клеток содержит также циклический гуанозинмонофосфат (cGMP, рис. 12-32), хотя его концентрация по крайней мере в 10 раз меньше концентрации сАМР. Известно, что cGMP служит активатором специфической протеинкиназы (G-киназы), фосфорилирующей в клетке определенные белки (см.
рис. 12-25), однако роль циклического GMP в передаче сигналов от рецепторов клеточной поверхности, за несколькими исключениями, не ясна.
Гуанилатциклаза, катализирующая образование cGMP из GTP, в отличие от аденилатциклазы обычно является растворимым ферментом и не сопряжена явным образом с поверхностными рецепторами, хотя уровень cGMP часто повышается при активации инозитолфосфолипидного пути.
Однако недавно в некоторых клетках были обнаружены формы гуанилатциклазы, связанные с плазматической мембраной, которые либо сопряжены с поверхностными рецепторами, либо сами выполняют их функцию.
Лучше всего сигнальная роль cGMP выяснена в реакции на свет палочек в сетчатке позвоночных, где cGMP прямо воздействует на Na+-
каналы плазматической мембраны. В отсутствие света молекулы cGMP связаны с натриевыми каналами и удерживают их в открытом состоянии.
Свет активирует в мембранных дисках палочек родопсин; активированный родопсин взаимодействует с G-белком трансдуцином, также активируя его. α-Субъединица трансдуцина (Tα) в свою очередь активирует cGMP-фосфодиэстеразу, которая гидролизует cGMP, резко снижая его концентрацию в цитозоле, и молекулы cGMP, связанные с натриевыми каналами, отделяются от них, позволяя им закрыться. Таким образом, световой сигнал преобразуется в электрический (подробнее см. разд. 19.6.7). Это прямое управление ионными каналами, осуществляемое сGМР, -
один из немногих известных случаев, когда циклический нуклеотид в клетках позвоночных действует независимо от протеинкиназы. Но этот случай не единственный; другой такой пример - обонятельные рецепторные клетки носа. Связывание некоторых пахучих веществ со специфическими рецепторными белками в этих клетках активирует (через одну из форм G5-белка) аденилатциклазу; это ведет к повышению концентрации сАМР в цитозоле, и сАМР непосредственно

Рис. 12-32. Циклический GMP.
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К. Уотсон Дж. Д. Молекулярная биология клетки: В 3-х т. 2-е изд. перераб. и доп. Т. 2.: Пер. с англ. – М.: Мир, 1993. – 539 с.
воздействует на натриевые каналы плазматической мембраны, открывая их и вызывая тем самым деполяризацию.
Несмотря на разницу в молекулярных деталях, все сигнальные системы, запускаемые рецепторами, сопряженными с G-белками, имеют ряд общих черт и основаны на сходных принципах. Все они, например, представляют собой сложные каскады или передаточные цепочки внутриклеточных посредников. Каковы же преимущества таких на первый взгляд запутанных систем, что они используются в столь многих типах клеток для столь разнообразных целей?
реакцию на внеклеточные сигналы [28]
В отличие от более прямых сигнальных систем, таких как системы стероидных гормонов, каталитические каскады внутриклеточных посредников предоставляют много возможностей для усиления и регулирования ответов на внеклеточные сигналы. Из рис. 12-33 видно, что, например, когда внешний лиганд активирует аденилатциклазу опосредованно, связываясь с рецептором, одна молекула рецептора может активировать много молекул СS-белка, каждая из которых способна активировать молекулу циклазы. В свою очередь каждая молекула аденилатциклазы превращает множество молекул АТР в сАМР. Такого же рода усиление происходит и в инозитолфосфо липидном пути. В результате наномолярные (10-9 М) концентрации внеклеточного лиганда нередко вызывают образование вторичных посредников, таких как сАМР или Са2+, в микромолярных (10~6 М) концентрациях. Так как сами эти молекулы являются аллостерическими эффекторами, активирующими определенные ферменты, одна внешняя сигнальная молекула способна вызвать изменения во многих тысячах молекул внутри клетки-мишени.
Кроме того, каждый белок в такой цепи может служить независимой мишенью для регуляторного воздействия, как, например, в каскаде расщепления гликогена в скелетных мышцах (разд. 12.4.1).
Работа такого рода «взрывных» метаболических каскадов должна жестко регулироваться. Не удивительно поэтому, что клетки обладают эффективными механизмами для быстрого расщепления сАМР и для понижения концентрации Са2 +, а также для инактивации ферментов и транспортных белков, активированных при ответе на сигнал. Ясно, что быстрое удаление или инактивация сигнальных молекул необходимы для выключения клеточного ответа; менее очевидно то, что они столь же важны и для его быстрого включения.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 990; Нарушение авторских прав?; Мы поможем в написании вашей работы!