
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Экспериментальная часть
|
|
|
|
Определение молярной массы углекислого газа
Лабораторная работа № 1.
Молярная масса - это масса одного моля вещества. Молем называется число Авогадро 6,02∙1023 молекул, атомов, ионов. Моль любого газообразного вещества при нормальных условиях (Ро=101,3 кПа, То=273К) занимает объем 22,4 л. Эта величина называется молярным объемом газа при нормальных условиях.
Определение молярной массы газа может быть выполнено несколькими способами. Чаще всего ее определяют, исходя из абсолютной и относительной плотности газа.
Абсолютной плотностью газа называется масса единицы объема газа при нормальных условиях: за единицу объема газа обычно принимают 1л. Зная массу и объем газа при нормальных условиях (н.у.) и его молярный объем 22,4л, можно определить молярную массу газа М, пользуясь уравнением Менделеева — Клапейрона:
pV = m/МRT
где Р - давление, кПа: V - объем, л; m - масса, г; М - молярная масса, г/моль; R - универсальная газовая постоянная; равная 8,314 л∙кПа/(моль∙К); Т - абсолютная температура.
Часто в лабораторной практике применяют следующие числовые значения:
R = 0.082 л∙атм/град∙моль;
R = 62360 мл∙мм.рт.ст./град∙моль.
Диоксид углерода получают в аппарате Киппа (рис.1) действием раствора соляной кислоты на мрамор. Полученный диоксид углерода очищают от брызг соляной кислоты путем промывания раствором гидрокарбоната натрия и осушают, пропуская через концентрированную серную кислоту. Чистую и сухую колбу плотно закройте резиновой пробкой до метки и взвесьте на технохимических весах с точностью до 0,001 г.
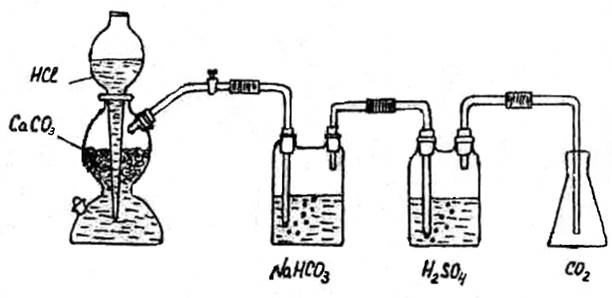
Рисунок 1 – Установка для получения и сбора углекислого газа.
Наполните колбу диоксидом углерода, получаемым в аппарате Киппа, в течении 3-4 минут. Затем очень медленно выньте газоотводную трубку из колбы.
Закройте колбу пробкой и снова взвесьте. Наполнение и взвешивание колбы необходимо производить 2-3 раза до постоянной массы, т. е. когда два последовательных результата либо одинаковы, либо отличаются друг от друга не более чем на 0,01 л.
Определите объем колбы, заполнив ее водой до метки и перелив воду в мерный цилиндр.
Запишите в журнал исходные данные:
1. массу колбы с воздухом (m1),
2. массу колбы с CO2 (m2),
3. объем колбы (V),
4. давление и температуру, при которых производился опыт.
Проведите предварительные расчеты:
1. Найдите объем колбы при нормальных условиях:
V→V0 = PVT0/P0T
2. Массу воздуха в колбе
Массу воздуха находим по уравнению Менделеева – Клапейрона. Средний молекулярная масса воздуха равна 29, a T=273+t.
3. Массу пустой колбы
4. Массу CO2 в колбе
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1640; Нарушение авторских прав?; Мы поможем в написании вашей работы!