
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лабораторная работа №2
|
|
|
|
Основные расчеты по определению молекулярной массы СО2 проводятся тремя способами.
1. Первое следствие закона Авогадро, согласно которому 1 моль любого газа при н.у. занимает объем 22,4 л., значит Х = 22,4л
2. Второе следствие закона Авогадро, согласно которому молекулярная масса вещества в газообразном состоянии равна его относительной плотности по воздуху умноженной на молекулярную массу воздуха:
M = 29Dвоздух
Можно так же рассчитать молекулярную массу СО2 по водороду, тогда M = 2DH, или по кислороду, тогда M = 32DО.
3. Вычислите молекулярную массу СО2 по уравнению Менделеева — Клапейрона:
М = mRT/PV
Подсчитайте ошибку опыта в процентах.
% ошибки = МСО2 эксп. / МСО2 теор. ∙ 100
Определение эквивалента магния методом вытеснения.
Опыты по определению эквивалентов металлов, способных вытеснять водород из разбавленных растворов кислот и щелочей, проводят в приборе, состоящем из 2-х бюреток, соединенных каучуковой трубкой, и двухколенной пробирки. Весь прибор укрепляется на металлическом штативе с помощью держателей (рис. 2).
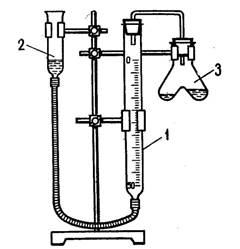
Рисунок 2 – Прибор для определения эквивалентов:
1 - бюретка; 2 - уравнительный сосуд; 3 - двухколенная пробирка.
1.Перед опытом следует проверить хорошо ли достигнута герметичность в приборе. Перемещая открытую бюретку вверх и вниз, следят за изменением уровня воды в бюретке. Если уровень не изменяется, или изменяется лишь незначительно, можно считать, что прибор герметичен.
2. Навеску магния поместить в одно из колен пробирки.
3. Отмерить мерным цилиндром 5 мл разбавленной серной кислоты (стоит в вытяжном шкафу) и через воронку перелить в пробирку в то колено, где нет навески магния.
4. Пробирку соединить с бюреткой и проверить герметичность прибора. Записать уровень воды в бюретке по нижнему мениску жидкости.
5. Наклонить пробирку таким образом, чтобы кислота перелилась в колено, где находится магний. Наблюдать выделение водорода и вытеснение воды из бюретки. Записать уровень воды в бюретке.
6. Записать показания термометра и барометра.
7. Написать уравнение реакции взаимодействия магния с серной кислотой.
ФОРМА ЗАПИСИ
1. Масса навески магния.
2. Уровень воды в бюретке до реакции (V1).
3. Уровень воды в бюретке после реакции (V2).
4. Температура опыта.
5. Давление в мм. рт. ст.
ОБРАБОТКА РЕЗУЛЬТАТОВНАБЛЮДЕНИЙ И ВЫЧИСЛЕНИЯ
1. Вычислить объем водорода, вытесненного магнием:
V = V2 - V1
2. Привести найденный объем водорода к нормальным условиям
(00С и 760 мм. рт. ст.)
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 1342; Нарушение авторских прав?; Мы поможем в написании вашей работы!