
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
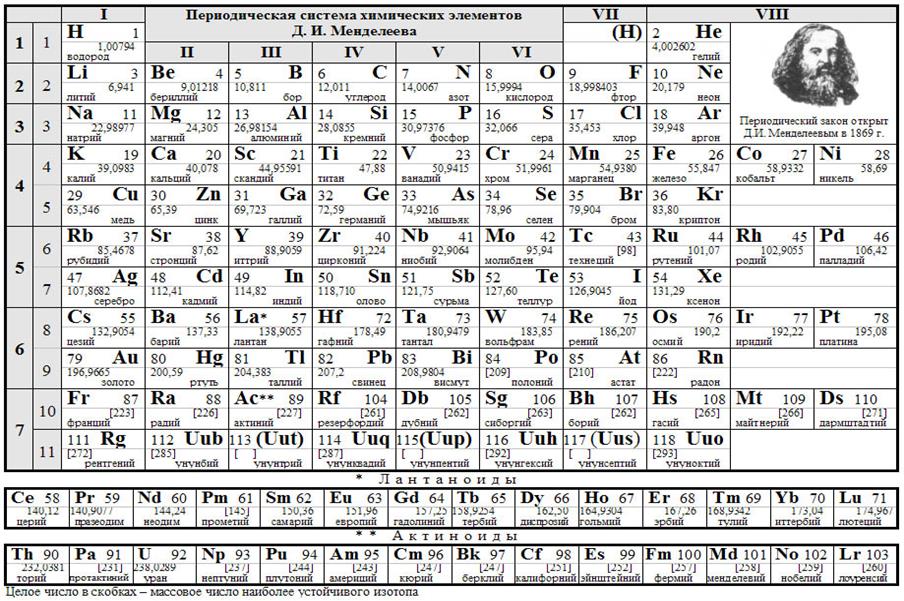
Периодическая система химических элементов Д.И. Менделеева
|
|
|
|
Некоторые физико-химические постоянные
| Наименование | Обозначение | Численное значение | Единицы |
| Постоянная Планка | h | 6,6261·10–34 | Дж/Гц |
| Атомная единица массы | а.е.м. | 1,6605·10–27 | кг |
| Постоянная Авогадро | NA | 6,022·1023 | моль–1 |
| Постоянная Фарадея | F | 9,6484·104 | Кл/моль |
| Универсальная газовая постоянная | R | 8,314 | Дж/(моль·К) |
| 0,082 | л·атм/(моль·К) | ||
| мл·мм·рт.ст./(моль·К) | |||
| Молярный объем идеального газа при нормальных условиях | Vm | 22,41 | л/моль |
| Нормальные физические условия | |||
| атмосферное давление | Р | 1,01325·105 | Па |
| термодинамическая температура | Т | 273,15 | К |
| °С |
Электроотрицательности (ЭО) элементов по Полингу
| Порядко-вый номер элемента | Элемент | ЭО | Порядко-вый номер элемента | Элемент | ЭО | Порядко-вый номер элемента | Элемент | ЭО |
| H | 2,1 | Fe | 1,8 | Sb | 1,9 | |||
| He | Co | 1,8 | Te | 2,1 | ||||
| Li | 1,0 | Ni | 1,8 | I | 2,5 | |||
| Be | 1,5 | Cu | 1,9 | Xe | ||||
| B | 2,0 | Zn | 1,6 | Cs | 0,7 | |||
| С | 2,5 | Ga | 1,6 | Ва | 0,9 | |||
| N | 3,0 | Ge | 1,8 | La | 1,1 | |||
| O | 3,5 | As | 2,0 | Hf | 1,3 | |||
| F | 4,0 | Se | 2,4 | Ta | 1,5 | |||
| Ne | Br | 2,8 | W | 1,7 | ||||
| Na | 0,9 | Kr | Re | 1,9 | ||||
| Mg | 1,2 | Rb | 0,8 | Os | 2,2 | |||
| Al | 1,5 | Sr | 1,0 | Ir | 2,2 | |||
| Fi | 1,8 | Y | 1,2 | Pt | 2,2 | |||
| P | 2,1 | Zr | 1,4 | Au | 2,4 | |||
| S | 2,5 | Nb | 1,6 | Hg | 1,9 | |||
| Cl | 3,0 | Mo | 1,8 | Tl | 1,8 | |||
| Ar | Tc | 1,9 | Pb | 1,8 | ||||
| K | 0,8 | Ru | 2,2 | Bi | 1,9 | |||
| Ca | 1,0 | Rh | 2,2 | Po | 2,0 | |||
| Sc | 1,3 | Pd | 2,2 | At | 2,2 | |||
| Ti | 1,5 | Ag | 1,9 | Rn | ||||
| V | 1,6 | Cd | 1,7 | Fr | 0,7 | |||
| Cr | 1,6 | In | 1,7 | Ra | 0,9 | |||
| Mn | 1,5 | Sn | 1,8 | Ac | 1,1 |
Энергии ионизации атомов и ионов
| Атомный номер | Элемент | I1 | I2 | Атомный номер | Элемент | I1 | I2 |
| эВ | эВ | эВ | эВ | ||||
| H | 13,599 | - | S | 10,36 | 23,35 | ||
| He | 24,59 | 54,42 | Cl | 12,97 | 23,80 | ||
| Li | 5,39 | 75,64 | Ar | 15,76 | 27,63 | ||
| Be | 9,32 | 18,21 | K | 4,34 | 31,82 | ||
| B | 8,298 | 25,16 | Ca | 6,11 | 11,87 | ||
| C | 11,26 | 24,38 | Sc | 6,562 | 12,80 | ||
| N | 14,53 | 29,60 | Ti | 6,82 | 13,58 | ||
| O | 13,62 | 35,12 | V | 6,740 | 14,21 | ||
| F | 17,42 | 34,99 | Cr | 6,765 | 16,50 | ||
| Ne | 21,57 | 41,08 | Mn | 7,435 | 15,64 | ||
| Na | 5,14 | 47,30 | Fe | 7,893 | 16,18 | ||
| Mg | 7,65 | 15,04 | Co | 7,87 | 17,06 | ||
| Al | 5,986 | 18,8 | Ni | 7,635 | 18,15 | ||
| Si | 8,15 | 16,34 | Cu | 7,726 | 20,29 | ||
| P | 10,49 | 19,73 | Zn | 9,394 | 17,96 | ||
| Ga | 6,09 | 20,51 | As | 9,82 | 18,62 | ||
| Ge | 7,90 | 15,94 | Se | 9,75 | 21,19 | ||
| Br | 11,84 | 21,8 | Pd | 8,336 | 19,43 | ||
| Kr | 14,0 | 24,5 | Ag | 7,576 | 21,49 | ||
| Rb | 4,18 | 27,5 | Cd | 8,994 | 16,9 | ||
| Sr | 5,69 | 11,0 | In | 5,78 | 18,9 | ||
| Y | 6,217 | 12,24 | Sn | 7,34 | 14,6 | ||
| Zr | 6,84 | 13,13 | Sb | 8,64 | 16,5 | ||
| Nb | 6,882 | 14,32 | Te | 9,01 | 18,6 | ||
| Mo | 7,10 | 16,15 | I | 10,45 | 19,1 | ||
| Tc | 7,28 | 15,26 | Xe | 12,13 | 21,3 | ||
| Ru | 7,366 | 16,76 | Cs | 3,89 | 25,1 | ||
| Rh | 7,46 | 18,08 | Ba | 5,2 | 10,0 |
Растворимость солей в воде при комнатной температуре
| Li+ | K+ | Na+ | NH4+ | Ba2+ | Ca2+ | Mg2+ | Sr2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Pb2+ | Сu2+ | |||
| F- | М | Р | Р | Р | М | Н | Н | Н | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | ||
| Cl- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | ||
| Br- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | ||
| I- | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | Р | ||
| ОH- | Р | Р | Р | Р | Р | М | М | ? | Н | Н | Н | Н | Н | Н | Н | Н | --- | --- | Н | Н | ||
| S2- | Р | Р | Р | Р | — | Р | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | ||
| HS- | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ||
| SO32- | Р | Р | Р | Р | Н | Р | М | Н | ? | — | Н | ? | Н | Н | ? | М | Н | Н | Н | ? | ||
| HSO3- | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ||
| SO42- | Р | Р | Р | Р | Н | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | ||
| HSO42- | Р | Р | Р | Р | ? | Р | ? | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ||
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ||
| NO2- | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ||
| PO43- | Н | Р | Р | Р | Н | — | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ||
| HPO42- | ? | Р | Р | Р | Н | Р | М | Н | ? | ? | Н | ? | ? | ? | Н | ? | ? | ? | М | ? | ||
| H2PO4- | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | Р | ? | ? | ? | Р | Р | Р | ? | — | ? | ||
| CO32- | Р | Р | Р | Р | Н | Р | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | Н | ||
| HCO3- | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | Р | ? | ? | ? | ? | ? | ? | ? | Р | ? | ||
| CH3COO- | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | Р | ||
| SiO32- | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ||
| Р– растворяется (>1 г на 100 г Н2О); М – мало растворяется (от 0,1 г до 1 г на 100 г Н2О); Н – не растворяется (<0,1 г на 100 г Н2О); | — – в водной среде разлагается; ? – нет достоверных сведений о существовании соединения. | |||||||||||||||||||||
Контрольные вопросы
1. Значение химии в народном хозяйстве и экологии. Успехи химической промышленности.
2. Основные законы химических превращений: закон сохранения массы вещества, закон постоянства состава, закон эквивалентов.
3. Эквивалент простых и сложных веществ.
4. Закон Авогадро. Методы определения молекулярных масс газов и паров. Молярный объем. Число Авогадро.
5. Открытие электронов и рентгеновских лучей.
6. Открытие и сущность явления естественной радиоактивности, альфа-, бета-, и гамма- излучение.
7. Планетарная модель строения атома по Резерфорду.
8. Заряд ядер атомов. Закон Мозли.
9. Понятие о волновых свойствах электронов. Постулаты Бора. Уравнение Луи Де-Бройля.
10. Характеристика энергетически состояний электрона четырьмя квантовыми числами. Принцип Паули. S- p- d- f- электроны.
11. Максимальная емкость электронных оболочек. Электронные формулы элементов. Правило Гунда.
12. Попытка классификации химических элементов до Д.И.Менделеева.
13. Открытие Менделеевым периодического закона.
14. Структура периодической системы химических элементов. Изменение свойств элементов по периодам и группам.
15. Современный этап развития периодической системы химических элементов. Заряд ядер атомов и периодическая система. Зависимость свойств элементов от строения их атомов.
16. Энергия ионизации и энергия сродства к электрону.
17. s p d f элементы и их место в периодической системе. Определение свойств элементов по их положению в периодической системе.
18. Понятие о составе атомных ядер. Изотопы и изобары. Значение периодического закона и его роль в развитии химии.
19. Формы химической связи. Ковалентная связь, механизм образования. Понятие об энергии связи.
20. Ионная связь. Структура ионных соединений.
21. Понятие о гибридизации химических связей и пространственная конфигурация молекул. σ, π и d – связи.
22. Полярность ковалентной связи. Дипольные моменты молекул.
23. Донорно – акцепторная связь, как разновидность ковалентной связи.
24. Понятие о методе молекулярных орбиталей. Связывающие и разрыхляющие обитали.
25. Представление о водородной связи.
26. Скорость химической реакции и ее зависимость от концентрации и температуры. Закон действующих масс и его математическое выражение.
27. Катализ и его формы. Механизм действия катализаторов. Биокатализаторы.
28. Обратимые и не обратимые химические процессы. Химическое равновесие. Константа равновесия.
29. Смещение химического равновесия. Принцип Ле–Шателье и его значение в химии.
30. Растворимость твердых, жидких и газообразных веществ. Зависимость растворения от температуры и давления.
31. Тепловые эффекты химических реакций. Закон Гесса.
32. Осмос и осмотическое давление растворов. Закон Вант – Гоффа.
33. Давление пара над раствором. Замерзание и кипение растворов. Закон Рауля.
34. Гидратная теория растворов Менделеева и ее роль в развитии химии.
35. Электропроводность растворов. Сущность теории электролитической диссоциации.
36. Теория сильных электролитов. Понятие об активности ионов.
37. Сильные и слабые электролиты. Константа диссоциации слабых электролитов.
38. Механизм диссоциации вещества. Гидратация ионов.
39. Степень диссоциации. Ступенчатая диссоциация. Амфотерные электролиты.
40. Взаимосвязь между степенью и константой диссоциации электролитов.
41. Растворимость малорастворимых электролитов. Произведение растворимости.
42. Концентрация растворов. Способы выражения концентрации.
43. Отклонение свойств растворов электролитов от законов Внт – Гоффа и Рауля. Понятие об изотоническом коэффициенте.
44. Диссоциация воды, ионное произведение воды, водородный показатель.
45. Ионные реакции и ионе уравнения.
46. Закон разбавления Оствальда. Условия смещения ионного равновесия.
47. Гидролиз солей. Применение закона действующих масс в реакциях гидролиза.
48. Типичные случаи гидролиза. Ступенчатый гидролиз.
49. Окислительно – восстановительные реакции, общие принципы составления ОВР.
50. Типы ОВР.
51. Реакции диспропорционирования (самоокисления и самовосстановления).
52. Важнейшие окислители и восстановители. Влияние среды на течение ОВР.
53. Механизм реакций окисения – восстановления. Степень окисления.
54. Основные положения координационной теории образования комплексных соединений.
55. Номенклатура комплексных соединений. Значение комплексных соединений в химии.
56. Устойчивость комплексных соединений. Константа нестойкости комплексного иона.
57. Изомерия комплексных соединений. Цис- и транс- форма.
58. Жесткость природных вод и способы ее устранения.
59. Цианамид кальция, его получение и применение.
60. Общая характеристика р-элементов IV-ой группы. Углерод. Аллотропия углерода. Оксид углерода (II).
61. Общая характеристика р – элементов V-ой группы. Азот, получение, свойства и применение. Нитриды.
62. Кислородные соединения азота.
63. Азотная кислота и ее соли.
64. Азотные удобрения.
65. Водородные соединения азота. Аммиак, его получение и применение. Соли аммония.
66. Фосфор в природе, получение и свойства. Аллотропии фосфора. Применение.
67. Кислородные соединения фосфора. Фосфорные кислоты и их соли.
68. Значение соединений фосфора. Фосфорные удобрения и их применение.
69. Общая характеристика р – элементов VI-ой группы. Сера и ее свойства.
70. Оксид серы (IV). Сернистый ангидрид. Сернистая кислота и ее соли.
71. Оксид серы (VI). Серный ангидрид. Серная кислота и ее соли.
72. Сероводород и его свойства. Сульфиды.
73. Сера в природе. Получение, свойства и применение.
|
|
|
|
|
Дата добавления: 2015-08-31; Просмотров: 507; Нарушение авторских прав?; Мы поможем в написании вашей работы!