
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграммы водяного пара
|
|
|
|
Определение параметров влажного насыщенного пара
Удельный объем влажного насыщенного пара находится из того, что в 1 кг его содержится x кг сухого пара и (1 - x) кг кипящей воды
v = v' (1-x) + v"x.
Энтальпия влажного насыщенного пара находится на основе следующих очевидных соображений. Точки a, b, c (рис.) отвечают одному и тому же давлению (одной и той же температуре насыщения). Поэтому тепло, подводимое на участке bc может быть определено по разности энтальпий в крайних точках процесса
 . (1)
. (1)
С другой стороны, q – это тепло, затраченное при p = const на получение из кипящей воды влажного пара, в каждом килограмме которого будет x кг сухого пара, т.е.
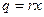 . (2)
. (2)
Совместное решение (1) и (2) дает
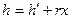 .
.
Энтропия влажного насыщенного пара находится, исходя из того, что она отличается от энтропии кипящей воды на величину, обусловленную количеством тепла, подводимого на участке bc. Поскольку на этом участке 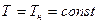 , постольку
, постольку
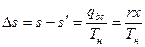
или

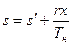 .
.
Ко всему сказанному выше следует добавить, что величина внутренней энергии насыщенного пара в таблицах не приводится. Для всех состояний она определяется на основе значений p, h, v
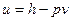 .
.
В инженерной практике для определения параметров состояния и анализа процессов используются не только таблицы водяного пара, но и соответствующие диаграммы.
Наиболее распространены T-S - и особенно i-S - диаграммы.
TS - диаграмма (рис. 2) используется для процессов парообразования и конденсации. Это тепловая диаграмма.
Площадь Sa a b Sb - теплота парообразования.
hS - диаграмма (рис. 3).
Расчет процессов изменения состояния реального газа (водяного пара) (рис. 3).
1. Изохорный процесс (V = const) 1v - аv - 2v.
1v - аv - изохорная подсушка влажного насыщенного пара. В ходе этого степень сухости (х = 1) т.е. вся жидкая фаза превращается в парообразную.
Происходит увеличение температуры, давления, энтальпии и энтропии.
аv - 2v - изохорный перегрев пара (происходит увеличение температуры, давления, энтальпии и энтропии).
U1-2 = h2 - h1 - V(p2 - p1)
l = 0 - работа расширения
q1-2 = DU1-2
2. Изобарный процесс (p = const) 1р - ар - 2р .
1р - ар - изобарная подсушка влажного насыщенного пара. В ходе этого степень сухости (х = 1) т.е. вся жидкая фаза превращается в парообразную.
Происходит увеличение энтальпии и энтропии при Р = const; T = const.
ар - 2р - изобарный перегрев пара (происходит увеличение температуры, энтальпии и энтропии при Р = const).
U1-2 = h2 - h1 - p(V2 - V1)
l = p (V2 - V1) – работа расширения
q1-2 = h2 - h1
3. Изотермический процесс (Т = const) 1т - ат - 2т .
1т - ат - изобарно - изотермическая подсушка влажного насыщенного пара. В ходе этого степень сухости (х = 1) т.е. вся жидкая фаза превращается в парообразную. Происходит увеличение энтальпии и энтропии при Р = const;
T = const (В идеальном газе при T = const - h = const, S = const).
В реальном газе учитывается потенциальная энергия межмолекулярных связей, поэтому происходит увеличение энтальпии и энтропии.
ат - 2т - изотермический перегрев пара (при T = const происходит увеличение энтальпии энтропии и внутренней энергии, уменьшается давление).
U1-2 = h2 - h1 - (p2V2 - p1V1)
l = q - DU
q1-2 = T(S2 -S1)
4. Адиабатный процесс (q = 0) 1s - 2s.
1s - 2s - адиабатное расширение.
При S = const понижается энтальпия, температура и давление.
DU = h2 - h1 - (p2V2 - p1V1)
l = DU
q1-2 = 0
DS = 0
|
|
|
|
|
Дата добавления: 2017-01-14; Просмотров: 417; Нарушение авторских прав?; Мы поможем в написании вашей работы!