
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Практикум по Физической химии
|
|
|
|
Утверждено Редакционным советом
университета в качестве учебного пособия
Москва
Составители: Т.Л. Антонова, В.Н. Балицкий, В.В. Белик, В.А. Ефремов, А.Ю. Крюков, В.Г. Клочкова, А.М. Мерецкий, К.Н. Жаворонкова. Под общей редакцией В.Ю. Конюхова
УДК 541.1 (075)
ББК 24.5я7
П69
Рецензенты:
Доктор химических наук, профессор кафедры физической и коллоидной химии Российского университета дружбы народов И. И. Михаленко
Доктор химических наук, заведующий кафедрой физической и коллоидной химии Московского государственного университета пищевых производств
К. И. Попов
Практикум по физической химии: учебное пособие/ сост. Т. Л. Антонова,
В. Н. Балицкий, В. В. Белик, В. А. Ефремов, А. Ю. Крюков, В. Г. Клочкова,
А. М. Мерецкий, К. Н. Жаворонкова; Под общей редакцией В. Ю. Конюхова –М. РХТУ им. Д. И. Менделеева. 2010. - 236 с.
Учебное пособие содержит описание лабораторных работ практически по всем разделам физической химии, каждому разделу предшествует краткое теоретическое введение. После описания работ приведены контрольные вопросы для самоподготовки.
Пособие соответствует действующей программе курса физической химии и предназначено для студентов всех специальностей.
УДК 541.1 (075)
ББК 24.5я7
ISBN 978-5-7237-0815-0
Ó Российский химико-технологический
Университет им. Д.И. Менделеева, 2010
ОГЛАВЛЕНИЕ
ОГЛАВЛЕНИЕ.. 2
Глава 1. СПЕКТРОХИМИЯ.. 7
1.1. Теоретические основы молекулярной спектроскопии. 7
1.1.1. Предмет и области приложения спектрохимии. 7
1.1.2. Взаимодействия электромагнитного излучения с. 8
веществом. 8
1.1.3. Закон светопоглощения Ламберта–Бугера–Беера. 11
1.1.4. Вращательные спектры поглощения двухатомных молекул. 15
1.1.5. Понятие о вращательных спектрах поглощения. 20
многоатомных молекул. 20
1.1.6. Определение молекулярных констант (геометрических характеристик) из вращательных спектров поглощения. 22
1.1.7. Колебательные спектры поглощения двухатомных молекул. 25
1.1.8. Определение колебательной постоянной, коэффициента ангармоничности и энергии диссоциации двухатомной молекулы по колебательному спектру поглощения. 33
1.1.9. Колебательно-вращательные спектры поглощения. 34
двухатомных молекул. 34
1.1.10. Определение волнового числа колебательно-вращатель-ной полосы и молекулярных констант по вращательно-колебатель-ному спектру поглощения 36
1.1.11. Колебательные состояния многоатомных молекул. 37
1.1.12. Общие представления о колебательных спектрах. 40
многоатомных молекул. 40
1.1.13. Электронные спектры поглощения. 48
1.1.13. Изучение равновесия диссоциации слабых электролитов в растворах. 49
1.2. Лабораторные работы.. 53
Работа 1.1. 53
Работа 1.2. 57
Работа 1.3. 60
2.1. Термохимические измерения. 65
2.1.1. Тепловые эффекты, теплоёмкость. 65
2.1.2. Описание калориметрической установки. 67
2.1.3. Проведение калориметрического опыта. 68
2.1.4. Определение величины Δ t 69
2.1.5. Определение суммарной теплоёмкость системы CW. 71
электрическим методом. 71
2.1.6. Определение суммарной теплоёмкости системы CW по. 72
теплоте растворении КCl 72
Работа 2.1. Определение удельной интегральной теплоты.. 73
растворения соли. 73
Работа 2.2. Определение истинной теплоёмкости раствора. 75
электрическим методом. 75
Работа 2.3. Определение средней теплоёмкости веществ. 77
Глава 3. Термодинамика фазовых равновесий.. 80
3.1. Основные понятия. Правило фаз. 80
3.2. Фазовые равновесия в однокомпонентных системах. 83
Работа 3.1. Определение давления насыщенного пара. 86
динамическим методом. 86
3.3. Фазовые равновесия в двухкомпонентных системах. 89
3.3.1. Общие представления о растворах. 89
3.3.2. Химический потенциал и активность компонента. 91
в растворе. 91
Работа 3.2. Определение молярной массы растворенного. 96
вещества криоскопическим методом. 96
Работа 3.3.Расчёт термодинамических характеристик растворов. 101
3.3.2. Равновесие жидкость–пар в двухкомпонентных. 107
жидких системах. 107
Работа 3.4. Построение диаграммы кипения для двухкомпонентных жидких смесей 111
Работа 3.5. Расчёт и построение диаграммы кипения бинарной смеси в предположении идеальных растворов. 114
3.3.3. Равновесие жидкость – твердая фаза в двухкомпонентных системах 116
Работа 3.6. Построение диаграммы плавкости неизоморфной смеси по кривым охлаждения. 122
Работа 3.7. Расчёт и построение диаграммы плавкости. 124
неизоморфной смеси в предположении идеальных растворов. 124
3.4. Фазовое равновесие в трёхкомпонентных системах. 128
Работа 3.8. Построение изотермы взаимной растворимости в трёхкомпонентной жидкой системе. 132
Глава 4. Электрохимия.. 136
4.1. Растворы электролитов в равновесных условиях. 136
4.1.1. Слабые электролиты.. 137
4.1.2. Сильные электролиты.. 140
4.2. Растворы электролитов в неравновесных условиях. 143
4.2.1. Электрическая проводимость растворов электролитов. 143
4.2.2. Методика измерения электрической проводимости. 152
растворов электролитов. 152
Работа 4.1. Зависимость электрической проводимости растворов слабых электролитов от концентрации. 154
Работа 4.2. Зависимость электрической проводимости растворов сильных электролитов от концентрации. 156
Работа 4.3. Определение растворимости малорастворимых солей при различных температурах кондуктометрическим методом. 158
Работа 4.4. Изучение влияния температуры на процесс. 161
диссоциации слабых электролитов. 161
Работа 4.5. Изучение влияния температуры на электрическую проводимость и вязкость растворов электролитов. 164
4.3. Равновесные электрохимические процессы в. 168
гальванических элементах. 168
4.3.1. Электрохимические цепи. 168
4.3.2. Методика электрохимических измерений. 183
Работа 6. Измерение ЭДС элемента Якоби–Даниэля. 189
Работа 4.7. Измерение ЭДС окислительно–восстановительных элементов 193
Работа 4.8. Определение стандартного потенциала. 199
окислительно-восстановительного электрода. 199
Работа 4.9. Определение термодинамических функций реакции, протекающей в гальваническом элементе. 204
Глава 5. Химическая кинетика и катализ. 207
5.1. Основные понятия химической кинетики. 207
5.2. Кинетика простых реакций. 212
5.2.1. Реакции первого порядка. 212
5.2.2. Реакции второго порядка. 214
5.2.3. Реакции нулевого порядка. 216
5.2.5. Реакции n -го порядка (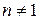 ) 217
) 217
5.2.6. Методы определения порядка реакции. 218
5.3. Зависимость скорости реакции от температуры.. 224
5.4. Кинетика цепных реакций. 227
5.4.1. Неразветвлённые цепные реакции. 228
5.4.2. Разветвлённые цепные реакции. 233
Работа 5.1. Изучение кинетики разложения пероксида водорода газоволюметрическим методом. 238
Работа 5.2. Изучение кинетики реакции иодирования ацетона. 241
Работа 5.3. Изучение кинетики гидролиза тростникового сахара (сахарозы). 244
Работа 5.4. Изучение кинетики гидролиза уксусного ангидрида методом электрической проводимости. 251
Работа 5.5. Определение коэффициента диффузии паров. 254
жидкости в воздухе методом увлечения. 254
Работа 5.6. Изучение кинетики испарения жидкости и определение коэффициента диффузии паров жидкости в воздухе методом адсорбции. 260
Приложение. 267
ЛИТЕРАТУРА.. 271
Глава 1. СПЕКТРОХИМИЯ
1.1. Теоретические основы молекулярной спектроскопии
1.1.1. Предмет и области приложения спектрохимии
При облучении физико-химической системы электромагнитным излучением происходит его взаимодействие с веществом. Анализ качественного и количественного состава электромагнитного излучения, поглощенного, рассеянного, испущенного или отражённого веществом, является предметом спектроскопического изучения.
Под спектром понимают электромагнитное излучение, разложенное (распределённое) по длинам волн или частотам.
Раздел спектроскопии, в котором используются спектральные измерения для получения информации о свойствах и строении молекул, о процессах, протекающих в химической системе, называется молекулярной спектроскопией или спектрохимией.
Спектрохимическое исследование позволяет получать ответы на самые разнообразные вопросы, возникающие перед химиком-исследователем. Среди них можно выделить следующие.
· Определение строения молекулы, её геометрических и энергетических характеристик (молекулярных констант).
· Изучение процессов межмолекулярного и ион-дипольного взаимодействия.
· Получение данных о термодинамических характеристиках (свойствах) вещества.
· Исследование химических равновесий и кинетики (скоростей) химических реакций.
· Качественный и количественный анализ химических соединений, идентификация и контроль степени их чистоты.
1.1.2. Взаимодействия электромагнитного излучения с
веществом
При рассмотрении всех взаимодействий электромагнитного излучения (в дальнейшем, света) с веществом важнейшим фактором, определяющим природу возникновения спектра, является квантование энергии молекул. В соответствии с положениями квантовой механики молекулы не могут обладать любой энергией, но только вполне опредёленными её значениями, т.е. энергетическое состояние молекулы квантовано. Другими словами, молекулы находятся в различных энергетических состояниях или на различных энергетических уровнях.
В рамках нашего курса мы будем рассматривать только раздел молекулярной спектроскопии, в котором изучаются спектры поглощения, т.е. спектры, появление которых связано с поглощением света веществом. Очевидно, что молекула может поглощать только такие кванты света, энергия которых точно равна разности энергий молекулы в различных энергетических состояниях (E', E''). Поглощая квант света, молекула переходит на более высокий энергетический уровень. Кванты света с энергией больше или меньше этой величины проходят через вещество не поглощаясь.
Энергия кванта света, как известно, определяется соотношением
 ,
,
где  – энергия кванта света, Дж; E', E'' – энергия молекулы, соответственно, в верхнем и нижнем энергетических состояниях, Дж; h – постоянная Планка, Дж∙с; c – скорость света, м/с;
– энергия кванта света, Дж; E', E'' – энергия молекулы, соответственно, в верхнем и нижнем энергетических состояниях, Дж; h – постоянная Планка, Дж∙с; c – скорость света, м/с; 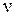 – частота колебаний света, c–1;
– частота колебаний света, c–1;  – волновое число, см–1, м–1;
– волновое число, см–1, м–1;  – длина волны, см, м.
– длина волны, см, м.
Весь спектр электромагнитного излучения простирается от длинных радиоволн до жёсткого γ-излучения. Для получения спектров молекул используется диапазон электромагнитного излучения от микроволновой до дальней УФ-области (табл. 1.1).
Таблица 1.1
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 159; Нарушение авторских прав?; Мы поможем в написании вашей работы!