
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Области электромагнитного излучения 3 страница
|
|
|
|

При этом постоянный дипольный момент молекулы может быть равен нулю. Примером могут служить, в частности, неполярные молекулы CO2, CH4, BF3, C6H6, для которых наблюдаются интенсивные полосы поглощения в ИК-области. В ходе ряда нормальных колебаний этих молекул происходит нарушение симметрии их равновесной конфигурации, сопровождающееся разделением центров тяжести положительных и отрицательных зарядов. В результате возникает «колебательный» дипольный момент и такие колебания оказываются активными в ИК-спектре поглощения. В качестве примера рассмотрим типы колебаний и колебательные спектры некоторых многоатомных молекул.
Линейные и нелинейные трёхатомные молекулы ХУ 2
На рис. 1.14 приведены (схематически, без соблюдения масштаба) формы колебаний молекул СО2 и H2O.

Рис. 1.14. Формы колебаний молекул СО2 (а) и Н2О (б)
Молекула СО2 линейная, в равновесном состоянии межъядерное расстояние r (С–О)=1,16∙10–10 м. Число колебательных степеней свободы этой молекулы равно 4, однако два деформационных колебания имеют одинаковую частоту, т.е. дважды вырождены. Движение ядер в этом случае можно представить как суммарный результат колебаний в двух взаимно перпендикулярных плоскостях. Таким образом, молекула СО2 имеет 3 частоты колебаний: ν1=1388,17 (валентное симметричное), ν2=667,4 (деформационное антисимметричное) и ν3=2349,16 см–1 (валентное антисимметричное). Из них частоты ν2 и ν3 удовлетворяют условию  , поэтому в ИК-спектре поглощения СО2 (рис. 1.15) наблюдаются две полосы, соответствующие частотам ν2 и ν3.
, поэтому в ИК-спектре поглощения СО2 (рис. 1.15) наблюдаются две полосы, соответствующие частотам ν2 и ν3.

Рис. 1.15. ИК спектр поглощения СО2
Молекула Н2О нелинейная, в равновесном состоянии межъядерное расстояние r (О–Н)=0,957·10–10 м, угол между связями  НОН=104°31'. Вырождение колебаний для неё отсутствует, и число колебательных степеней свободы совпадает с числом частот колебаний: ν1= 3656,65, ν2=1594,78 и ν3=3755,79 см–1. Все три частоты удовлетворяют условию
НОН=104°31'. Вырождение колебаний для неё отсутствует, и число колебательных степеней свободы совпадает с числом частот колебаний: ν1= 3656,65, ν2=1594,78 и ν3=3755,79 см–1. Все три частоты удовлетворяют условию  и поэтому наблюдаются в ИК–спектре поглощения.
и поэтому наблюдаются в ИК–спектре поглощения.
Пирамидальные четырёхатомные молекулы ХY 3
Примером такой молекулы служит молекула аммиака NH3. Три атома водорода лежат в основании симметричной пирамиды, вершину которого занимает атом азота (рис. 1.16). В равновесном состоянии межсвязевый угол  HCH = 107o17', а межъядерное расстояние rN-H = 1,0156·10–10 м.
HCH = 107o17', а межъядерное расстояние rN-H = 1,0156·10–10 м.

Рис. 1.16. Строение молекулы аммиака
Число колебательных степеней свободы для молекулы NH3 равно 6, однако из-за симметричного строения два колебания оказываются дважды вырожденными, вследствие чего молекула NH3, имеет только 4 колебательные частоты (табл. 1.5):  см–1,
см–1,  см–1,
см–1,  см–1,
см–1,  см–1.
см–1.
На рис. 1.17 приведен ИК-спектр поглощения аммиака. Как видно, в ИК-спектре наблюдаются все четыре полосы поглощения, соответствующие различным типам нормальных колебаний, хотя интенсивность обоих антисимметричных колебаний  и
и  заметно ниже таковой для симметричных колебаний
заметно ниже таковой для симметричных колебаний  и
и  .
.
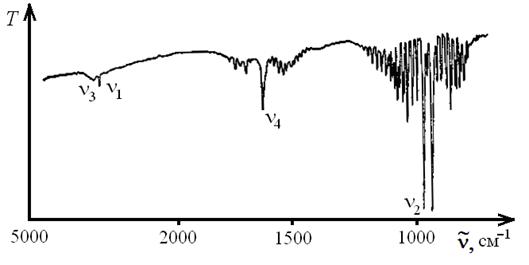
Рис. 1.17. ИК спектр поглощения аммиака
Каждая полоса в ИК-спектре молекулы NH3 расщепляется на две вследствие так называемого "инверсионного удвоения". Указанное явление возникает в пирамидальных молекулах, для которых равновероятны две конфигурации (рис. 1.18а). Если потенциальный барьер между этими состояниями невелик, то молекула может переходить из одной конфигурации в другую. В результате, каждый колебательный уровень расщепляется на два (положительный и отрицательный). В ИК-спектре поглощения разрешены переходы между двумя уровнями различных знаков (рис. 1.18б). Инверсионное расщепление наиболее явно наблюдается для частот симметричных деформационных колебаний.
 Рис. 1.18. Равновесные конфигурации молекулы аммиака (а); разрешённые колебательные переходы в ИК-спектре поглощения (б)
Рис. 1.18. Равновесные конфигурации молекулы аммиака (а); разрешённые колебательные переходы в ИК-спектре поглощения (б)
Так же, как и в случае двухатомных молекул, колебательные переходы в многоатомных молекулах сопровождаются вращательными переходами. Поэтому в спектрах поглощения веществ в газовой фазе можно наблюдать тонкую структуру, обусловленную переходами между вращательными уровнями основного ( ) и вращательными уровнями возбуждённого (
) и вращательными уровнями возбуждённого ( ) колебательного состояний. В отличие от двухатомных молекул, в колебательно-вращательной полосе поглощения многоатомных молекул наряду с Р -ветвью (D J = -1) и R -ветвью (D J = +1) может наблюдаться также лежащая между ними Q -ветвь, соответствующая переходам с D J = 0 (рис. 1.19).
) колебательного состояний. В отличие от двухатомных молекул, в колебательно-вращательной полосе поглощения многоатомных молекул наряду с Р -ветвью (D J = -1) и R -ветвью (D J = +1) может наблюдаться также лежащая между ними Q -ветвь, соответствующая переходам с D J = 0 (рис. 1.19).

Рис.1.19. Колебательно-вращательная полоса антисимметричного колебания газообразного метана
Волновое число колебательной полосы в спектре определяют по положению Q -ветви, которая на вращательные линии не расщепляется. Если же Q -ветвь не наблюдается, положение полосы определяют по "нулевой линии" между P - и R -ветвями так же, как это делают в случае двухатомных молекул.
Колебательно-вращательные полосы, отвечающие тому или иному нормальному колебанию молекул, широко используют для изучения характеристик вращательного движения этих молекул. По волновым числам тонкой вращательной структуры полосы поглощения определяют вращательные постоянные и рассчитывают моменты инерции и геометрические параметры молекул исследуемого вещества. Особенно ценно, если колебательно-вращательная полоса наблюдается в случае неполярных молекул, чисто вращательные спектры поглощения для которых, как отмечалось ранее, не могут быть получены.
Любое вещество имеет свой, только ему присущий колебательный спектр, состоящий из набора полос и линий разной частоты и интенсивности. Однако исследование колебательных спектров большого количества соединений позволило заметить, что некоторые частоты в ИК-спектрах поглощения связаны с наличием в молекулах определённых связей или групп атомов. Соответствующие полосы поглощения появляются в спектрах различных веществ, причём нередко сохраняется не только частота, но и интенсивность поглощения.
Полосы поглощения, характерные для конкретной группы атомов и появляющиеся в определённой области частот ИК-спектра при наличии в молекуле этих структурных элементов, называются характеристическими полосами, а соответствующие им частоты – характеристическими частотами.
Характеристические частоты служат основой качественного анализа по спектрам поглощения и позволяют химикам идентифицировать химические соединения. В настоящее время имеются атласы и автоматизированные картотеки спектров, с помощью которых можно, с одной стороны, отождествить любое соединение, если для него ранее был получен колебательный спектр, а, с другой, установить наличие в синтезируемом (неизвестном) соединении тех или иных структурных и функциональных групп или химических связей.
1.1.13. Электронные спектры поглощения
Электронные спектры поглощения вещества наблюдаются в видимой и ультрафиолетовой областях (УВИ-область), где энергия кванта света достаточна для перевода валентных электронов из основного состояния на возбуждённые энергетические уровни. Как и в случае колебательно-вращательных спектров, чисто электронные переходы не наблюдаются. Одновременно с электронными переходами имеют место изменения вращательных и колебательных состояний. Так что в УВИ-области фактически наблюдаются электронно-колебательно-вращательные спектры. Для вещества в газовой фазе они представляют собой набор многочисленных полос поглощения, в которых проявляется колебательная и вращательная структура. Отсюда их часто называют полосатыми спектрами. Электронные спектры газообразных веществ могут быть использованы для определения молекулярных констант, причём, как для гетероядерных и гомоядерных двухатомных, так и полярных и неполярных многоатомных молекул.
Главная ценность электронных спектров заключается в том, что они позволяют изучать электронные переходы в молекуле, получать сведения об ионизационных потенциалах и энергиях разрыва связей, могут быть использованы для целей идентификации и структурно-группового анализа различных классов соединений. Электронные спектры широко применяются для изучения строения комплексных соединений, исследования различного рода равновесий в растворах, для контроля степени чистоты. К тому же электронные спектры выгодно отличаются от колебательных спектров поглощения более высокой интенсивностью и поэтому они чаще используются для количественных определений в аналитической химии.
Структурные элементы молекулы (изолированные функциональные группы), ответственные за данную полосу в видимой или УФ-областях, называются хромофорами. Поглощение света данным изолированным хромофором, не сопряжённым с другими подобными группами, является характеристичным, т.е. характеризуется двумя количественными параметрами: длиной волны максимума полосы поглощения – lmax и молярным коэффициентом поглощения (погашения) в максимуме поглощения – emax. Эти характеристики для многих простых и сопряжённых хромофорных групп можно найти в справочной литературе.
Таким образом, электронные спектры поглощения в УВИ-области совместно с вращательными и колебательно-вращательными спектрами в микроволновой и ИК-областях позволяют получать достаточную информацию для решения многих качественных и количественных задач в области физической и аналитической химии.
1.1.13. Изучение равновесия диссоциации слабых электролитов в растворах.
Для изучения диссоциации слабых электролитов и определения степени и константы диссоциации часто пользуются спектрофотометрическим методом, основанном на различии в электронном спектре поглощения молекулярной и ионизированной форм данного вещества в растворе.
Пусть какая-либо кислота диссоциирует по схеме:
НА  Н+ + А–,
Н+ + А–,
Так как при данной степени диссоциации 0<α<1 в растворе находятся как молекулы НА, так и анионы А–, в спектре (в видимой и/или в ультрафиолетовой областях) раствора будут одновременно наблюдаться по крайней мере две полосы (сольватированный ион водорода не поглощает во всей УВИ области). При изменении степени диссоциации (вследствие разбавления раствора, изменения рН, температуры или природы растворителя) соотношение между интенсивностями этих полос будет меняться. В пределе при α=1 в спектре останется только одна полоса, соответствующая поглощению аниона А–. В другом предельном случае при α=0 эта полоса исчезнет, а поглощение, отвечающее молекуле НА, достигнет максимальной для данной концентрации интенсивности.
На рис. 1.20 представлен пример семейства кривых поглощения, отвечающих различным степеням диссоциации при различных значениях рН слабой органической кислоты параоксипропиофенона, который в воде диссоциирует следующим образом:
HO-C6H4CO-C2H5  Н+ + (О-С6Н4-СО-С2Н5) –
Н+ + (О-С6Н4-СО-С2Н5) –
Все кривые пересекаются в одной "изобестической" точке, где оптическая плотность не зависит от рН, так как интенсивность поглощения частиц обоих видов при этой длине волны одинакова.

Рис. 1.20. Спектр поглощения параоксипропиофенона при различных рН: 1–4.0; 2–5.0; 3–7.0; 4–8.0; 5–8.5; 6–11.0; 7–12.0
Слева и справа от изобестической точки оптическая плотность i-го раствора с данным значением рН будет складываться из поглощения молекулярной и анионной форм:
Ai=εHACHAl + εA-CA-l (1.22)
Если общая концентрация вещества в растворе равна С, а степень диссоциации кислоты в i-м растворе равна αi, то
 (1.23)
(1.23)
или
 (1.24)
(1.24)
где 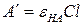 и
и  – предельные оптические плотности раствора, соответственно, в кислой (α=0) и в щелочной (α =1) среде при λ=const.
– предельные оптические плотности раствора, соответственно, в кислой (α=0) и в щелочной (α =1) среде при λ=const.
Из уравнения (1.24) находим:
 (1.25)
(1.25)
Все значения здесь должны быть измерены при одной длине волны, соответствующей максимуму поглощения молекулярной или анионной форм.
Таким образом, величину α можно найти для каждого раствора с данным значением рН, причем расчеты можно вести как по одной, так и по другой полосе поглощения. Для параоксипропиофенона λ1=273 нм, λ2=323 нм.
Термодинамическая константа диссоциации может быть выражена через активности ионов и молекул в растворе:
 (1.26)
(1.26)
Если в первом приближении считать раствор идеальным, т.е. принять, что коэффициенты активности равны 1, то выражение для константы примет вид
 (1.27)
(1.27)
Так как  , а
, а  , то дробь
, то дробь  можно заменить на
можно заменить на 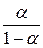 . Тогда после подстановки и логарифмирования получаем:
. Тогда после подстановки и логарифмирования получаем:
 (1.28)
(1.28)
Вводя величины  и
и  , можно записать окончательное уравнение для расчета рКс:
, можно записать окончательное уравнение для расчета рКс:
 (1.29)
(1.29)
Расчет по этому уравнению дает значение логарифма идеальной, или кажущейся константы диссоциации (функции концентрации), которая зависит от ионной силы раствора. Если получить ряд значений рК при различной ионной силе раствора, можно найти значение рКа, применяя графическую экстраполяцию на нулевую ионную силу.
Решение по уравнению (1.29) можно провести и графически. Если α=0.5 то рКС = рН1/2 (второе слагаемое в равенстве (1.29) равно 0), где pH1/2 – так называемый "половинный показатель", т.е. значение рН, при котором 50% вещества находится в диссоциированном состоянии.
Для нахождения pH1/2 строят график зависимости А=f(рН) при λ1 и при λ2 и по полувысотам полученных кривых находят значение pH1/2=рКС. Пример графического способа расчета рКС для параоксипропиофенона при λ2 приведен на рис. 1.21.

Рис. 1.21. Графическое определение рКС параоксипропиофенона при λ2.
Значение рКС= рН1/2=8.1,
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 244; Нарушение авторских прав?; Мы поможем в написании вашей работы!