
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Неравновесные явления в растворах электролитов
|
|
|
|
Электрохимические системы составлены из проводников первого и второго рода. К проводникам первого рода относятся все металлы, сплавы, графит, уголь, некоторые твердые оксиды, карбиды и сульфаты металлов.
Металлические проводники состоят из положительно заряженных ионов и отрицательно заряженного электронного газа, образованного коллективизированными электронами. Электронный газ равномерно заполняет все пространство между ионами, находящимися в узлах кристаллической решетки. Согласно электронной теории, протекание тока в проводниках первого рода сопровождается различными физическими явлениями (нагревание, намагничивание и т.д.), но не приводит к химическим изменениям. Электропроводность металлических проводников высока.
Ниже приведена удельная электропроводность некоторых материалов при 18 °С (табл. 1.2).
Таблица 1.2
Удельная электропроводность некоторых материалов
| Материалы | Удельная электропроводность, См/м |
| Проводники первого рода | |
| серебро | |
| алюминий | |
| платина | |
| ртуть | |
| уголь | |
| Проводники второго рода | |
| NaCl / расплавленный / | 3,40 |
| AgNO3 | 0,65 |
| H2SO4 / 30 %-й раствор | 0,74 |
| KCl / 1 н раствор / | 9∙10–2 |
| C2H5OH | 3∙10–6 |
| H2O | 4∙10–8 |
| Диэлектрики | |
| сера | 2∙10–16 |
| кварц | 5∙10–17 |
| парафин | 10–18 |
Водные и неводные растворы, расплавленные, твердые соли и некоторые окислы, проводящие электрический ток, так как несут положительные и отрицательные заряды, называются электролитами и относятся к проводникам второго рода. Проводники второго рода обладают значительно меньшей проводимостью, чем проводники первого рода.
Фундаментальное значение в электрохимии имеют границы раздела между проводниками первого и второго рода, поскольку именно здесь изменяется характер электрической проводимости: электронная проводимость метала или полупроводника сменяется ионной проводимостью раствора, расплава или твердого электролита. При протекании постоянного тока такая смена характера электрической проводимости неизбежно сопровождается электрохимическими превращениями тех или иных веществ: их электровосстановлением с присоединением электронов или электроокислением с отщеплением электронов.
Электролиты оказывают сопротивление прохождению через них электрического тока. Сопротивление это прямо пропорционально межэлектродному расстоянию l и обратно пропорционально площади поперечного сечения электролита S. Если электролитический проводник имеет форму куба, длина ребра которого равна 1 см (l = 1 см, S = 1 см2), то
 , (1.11)
, (1.11)
где ρ – коэффициент пропорциональности, зависящий от природы раствора и называется его удельным сопротивлением, Ом×м.
Величина, обратная удельному сопротивлению проводника – удельная электропроводность
 , (1.12)
, (1.12)
 , (1.13)
, (1.13)
где c– удельная электропроводность – электропроводность кубика вещества с длиной ребра 1 см. Размерность удельной электропроводности Ом–1×см–1 или См×м–1 (См – сименс).
Сопротивление электролитов, как и проводников первого рода, при обычных условиях не зависит от приложенного извне напряжения. Следовательно, для них справедлив закон Ома
 , (1.14)
, (1.14)
то, подставляя значение R, находим
 . (1.15)
. (1.15)
Падение напряжения в электролите пропорционально плотности тока i, и обратно пропорционально удельной электропроводности χ, которая определяется природой электролита, концентрацией раствора, природой растворителя и температурой.
Зависимость удельной электропроводности от температуры выражается уравнением
 , (1.16)
, (1.16)
где c t – удельная электропроводность электролита при t °С.
В водных растворах с повышением температуры ослабляется эффективность межионного и межмолекулярного взаимодействия. В результате этого сокращается гидратная оболочка ионов и величина их эффективных радиусов, уменьшается торможение движению ионов. Все это, несмотря на возрастающую с температурой беспорядочность движения ионов, способствует увеличению их электропроводности. В слабых электролитах возрастает их диссоциация с ростом температуры.
Для бинарных электролитов
 , (1.17)
, (1.17)
или
 . (1.18)
. (1.18)
Если, определить удельные электропроводности различных растворов в зависимости от их концентрации, то можно наблюдать следующую зависимость (рис. 1.3).

Рис.1.3. Зависимость удельной электропроводности электролитовотконцентрации растворов
При максимальном разбавлении раствора величина его удельной электропрводности стремится к удельной электропроводности чистой воды (~ 10–5 См/м).
Как видно из рис. 1.3 зависимость электропроводности от концентрации, как правило, имеет максимум. Вследствие ион-ионного взаимодействия ее величина снижается при высоких концентрациях. Наличие такой аномальной зависимости делает неудобным использование величин удельной электропроводности, поэтому целесообразно ввести понятие эквивалентной электропроводности, которое обозначается буквой l и определяется соотношением
 , (1.19)
, (1.19)
где l – эквивалентная электропроводность электролита, м2/Ом×г-экв;
С – концентрация электролита, г-экв/л.
Согласно (1.19) эквивалентная электропроводность является удельной электропроводностью отнесенной к единице концентрации раствора. Она представляет собой электропроводность объема электролита, содержащего 1 г – эквивалент растворенного вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга.
Если бы потоки миграции не зависели от ион-ионного взаимодействия, то l сохраняло бы постоянство при всех концентрациях. Однако при высоких концентрациях эквивалентная электропроводность не постоянна (рис. 1.4). При бесконечном разбавлении раствора, она стремится к своему постоянному значению.

Рис. 1.4. Зависимость эквивалентной электропроводности от разбавления
Существует связь между эквивалентной электропроводностью lи абсолютной скоростью движения ионов Ui
 , (1.20)
, (1.20)
где a– степень диссоциации и 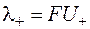 ,
,  , а U+, U– – абсолютные подвижности катиона и аниона.
, а U+, U– – абсолютные подвижности катиона и аниона.
Величины l+ и l– носят названия подвижностей ионов. Для сильных электролитов (a = 1)
 . (1.21)
. (1.21)
При бесконечном разбавлении
 , (1.22)
, (1.22)
где 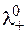 и
и  – предельные подвижности ионов.
– предельные подвижности ионов.
Электропроводность раствора в основном определяется электропроводностью электролита, которая в каждом сечении потока зависит от газонаполнения и температуры протекания анодных и катодных процессов. Непосредственно у электролитов электропроводность приэлектродных слоев в значительной мере отличается от электропроводности раствора в ядре потока. Выделение газов (водорода на катоде, кислорода на аноде), защелачивание у катода и закисление у анода, гидролиз продуктов анодного растворения в прианодном слое и другие вторичные процессы у анода /например, окислительно-восстановительные реакции низковалентных ионов с окислителями – протонами воды и анионами – все это в совокупности ведет к изменению электропроводности у электролитов. Реальные электропроводности электролитов в приэлектродных слоях значительно отличаются от первоначальной электропроводности в ядре потока.
Сильные электролиты существуют в растворах в виде ионов, но их подвижности, уменьшаются из-за межионного взаимодействия (табл. 1.3).
Далее рассмотрим общую характеристику неравновесных явлений в растворах электролитов. Вызвать в растворе электролита неравновесные явления можно следующими способами:
1) изменением концентрации растворенного вещества в одной части раствора по отношению к другой без изменения химического состава раствора, т.е. количеств перескоков данной частицы i в направлении уменьшения ее концентрации оказывается больше, чем количество перескоков этой частицы в обратном направлении. В результате возникает поток диффузии;
2) наложением электрического поля, которое вызовет направленное перемещение заряженных частиц, т.е. возникают потоки миграции катионов и анионов, которые составляют основу электропроводности электролитов;
3) изменением состава раствора по отношению к равновесной концентрации возможных для данной системы веществ. В результате изменения состава раствора нарушает ионное равновесие и вызывает химическую реакцию, в ходе которой происходит восстановление ионного равновесия.
Таблица 1.3
Предельные подвижности ионов в воде
при различных температурах
| Ион |  (См·м2/г.-экв.) (См·м2/г.-экв.)
| ||||
| 0°С | 18°С | 25°С | 45°С | 100°С | |
| Li+ Na+ K+ [(CH3)4N]+ [(C2H5)4N]+ | 19,4 26,5 40,7 24,4 16,4 | 32,8 42,8 63,9 28,2 | 38,7 50,1 73,5 44,9 32,7 | 73,7 103,5 – – | – – |
| F– Cl– Br– I– CH3COO– | – 42,6 41,4 20,1 | 47,3 66,5 | 65,4 76,4 76,8 40,9 | – 108,9 110,7 108,6 – | – – – – |
Сдвиг равновесия в сторону более положительных или отрицательных значений потенциала называется поляризацией.
Возникновение электродной поляризации определяется скоростью наиболее замедленной стадии. Природа и число стадий электрохимических реакций зависят от их характера:
1. Диффузия исходных веществ к поверхности.
2.Собственно электрохимическая реакция у поверхности электрода.
3. Стадия превращения продуктов в конечные продукты, устойчивые при данных условиях: а) диффузия веществ раствора; б) молизация; в) формирование кристаллической решетки.
Причиной анодной и катодной поляризации являются: замедленность электрохимической стадии разряда, ионизации; химические и концентрационные изменения.
Поляризация характеризует энергетические безвозвратные потери, происходящие вследствие необратимого процесса и зависящие от величины плотности тока. Электродную поляризацию в общем случае делят на концентрационную поляризацию и перенапряжение.
При пропускании постоянного тока через раствор, электролит претерпевает химическое разложение в результате реакций окисления и восстановления, протекающих на электродах. Электролиз с инертными электродами чаще всего сопровождается разрядом катионов на катоде и анионов на аноде. Для начала электролиза к электродам необходимо приложить некоторое минимальное напряжение, называемое напряжением разложения. Суммарное изменение электродных потенциалов под током называется ЭДС поляризации. На рис. 1.5 представлена кривая напряжения разложения.

Рис. 1.5. ЭДСванн = ЭДСо + ЭДСом + ЭДСпол,
ЭДСом – омические потери напряжения, ЭДСпол – ЭДС поляризации,
ЭДСо – равновесная разность потенциалов
При включении тока и подаче на электролизер небольшого напряжения наблюдается сначала резкий скачок. А затем быстрое падение тока. Это связано с тем, что на электродах появляются продукты электролиза. Между электродами, представляющими собой гальваническую пару, например, (Pt)H2|HCl|Cl2(Pt). Возникает электродвижущая сила поляризации, направленная противоположно приложенному извне напряжению. Дальнейшее повышение приложенного напряжения сопровождается ростом силы тока и количества продуктов электролиза на электродах. Поскольку при этом возрастает ЭДС поляризации, то происходит незначительное увеличение силы тока. Начиная, с момента выделения газов в виде пузырьков в атмосферу, концентрация газообразных продуктов электролиза на поверхности электродов увеличиваться больше не будет и ЭДС поляризации достигнет своей максимальной величины. Последующее увеличение приложенного напряжения приведет к резкому увеличению силы тока, причем он будет расти линейно.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 153; Нарушение авторских прав?; Мы поможем в написании вашей работы!