
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика диффузионных электрохимических процессов
|
|
|
|
Протекание тока в электролите обусловлено тремя механизмами переноса заряженных частиц – миграционным, диффузионным и конвективным. Преобладающее влияние той или иной составляющей на величину плотности тока определяется кинетикой электродных реакций.
Изменение концентрации вещества вблизи электрода приводит к возникновению диффузии, которая стремится восстановить концентрацию в приэлектродном пространстве.
Связанные с таким изменением отклонения от начальной плотности электролита приводят к появлению конвективных потоков; одновременно с этим под действием наложенного извне электрического поля происходит миграция ионов в электролите.
В любом электрохимическом процессе возникает разница в концентрациях растворенных веществ вблизи электрода и в объеме раствора, что приводит к диффузии. Так как концентрационные изменения всегда сопутствуют электрохимическому процессу, молекулярная диффузия происходит во всех электродных реакциях.
Вторым способом массопереноса служит перенос частиц под действием электрического поля. Так как раствор электролита обладает некоторым омическим сопротивлением, то при протекании через него тока возникает омическое падение потенциала, под действием которого скорость движения ионов изменяется. Это явление называется миграцией.
Конвекция – перенос вещества вместе с потоком движущейся жидкости. Этот механизм переноса можно создать искусственно, применяя размешивание. При образовании газообразных продуктов размешивание раствора вызывают пузырьки газа, отрывающиеся от поверхности электрода. Конвекция не может устранить диффузию, так как, при приближении к поверхности электрода скорость движения жидкости падает и, с другой стороны, одновременно возрастает градиент концентрации.
В соответствии с тремя механизмами массопереноса, скорость разряда равна суммарной скорости доставки компонента к поверхности электрода
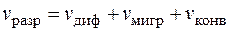 . (1.32)
. (1.32)
Рассмотрим распределение эквивалентной концентрации катионов С к, анионов С а и С электролита в целом вблизи поверхности электрода (рис. 1.6)
На рис. 1.6 представлены: μ – толщина двойного слоя, δ – толщина диффузионного слоя, С 0 – концентрация в глубине раствора.
Если лимитирующей стадией электродного процесса является подвод реагирующего вещества к поверхности электрода, то это означает, что все вещество, которое подходит к электроду, сразу же разряжается, а потому, количество продиффундированных в единицу времени к единице поверхности катионов, согласно первому закону Фика, составит
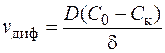 , (1.33)
, (1.33)
где D – коэффициент диффузии,
С 0 – начальная концентрация катионов, участвующих в электродной реакции
С к – концентрация катионов у поверхности катода, г-экв/л.
Соотношение (1.33) представляет собой первое основное уравнение диффузионной кинетики.
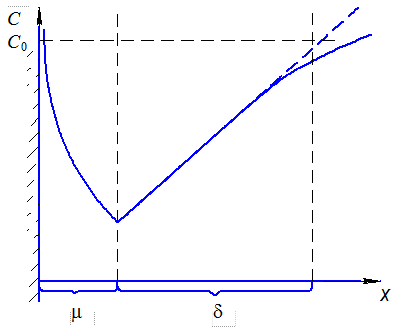
Рис. 1.6. Распределение эквивалентной концентрации электролита
вблизи поверхности электрода
Величина плотности тока связана со стационарной концентрацией ионов у поверхности катода
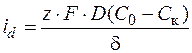 . (1.34)
. (1.34)
Если скорость велика, то С = 0
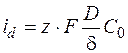 . (1.35)
. (1.35)
Скорость диффузии потенциал определяющих компонентов электродных реакций через диффузионный слой определенной толщины пропорциональна разности концентраций соответствующих частиц на границах этого слоя.
При условии медленного подвода реагирующего вещества к поверхности, поляризация связана с изменением концентрации вещества у поверхности по сравнению с концентрацией в объеме раствора и называется концентрационной поляризацией. Поэтому второе основное уравнение диффузионной кинетики – уравнение Нернста для определения поляризации. Для электродов первого рода потенциал определятся соотношением
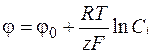 , (1.36)
, (1.36)
где Сi – концентрация потенциалопределяющих ионов в объеме раствора;
φ0 – стандартный потенциал данной системы.
При прохождении тока потенциал электрода будет определяться концентрацией реагирующего вещества у поверхности Сs
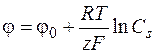 . (1.37)
. (1.37)
Таким образом, поляризация электрода
 . (1.38)
. (1.38)
Соотношение (1.38) является вторым основным уравнением диффузионной кинетики.
Если лимитирующая стадия – стадия массопереноса, т.е. процесс протекает в условиях нестационарной диффузии, по второму закону Фика, то
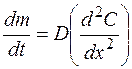 , (1.39)
, (1.39)
где 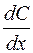 – градиент концентрации.
– градиент концентрации.
Данное уравнение характеризует изменение градиента концентрации растворенного вещества во времени и непостоянство концентрации по длине диффузионного слоя.
При отсутствии электрического тока концентрация ионов металла во всех точках раствора одинакова и равна С 0. Если же через ячейку пропускать электрический ток, то на катоде разрядятся ионы Ме+. Естественно при этом полагать, что в результате диффузии некоторое количество ионов подойдет к катоду из глубины раствора, но так как ионы могут перемещаться только вследствие некоторого градиента концентрации, то у поверхности катода концентрация Ме+ понизится до некоторой величины С к, где С к < С 0.
Выясним зависимость концентрационной поляризации от плотности тока для катодного процесса. Пусть S к– площадь катода, t – время, необходимое для прохождения одного фарадея электричества F, z – заряд ионов, участвующих в катодной реакции, i к – катодная плотность тока.
Так как
 . (1.40)
. (1.40)
Если nк – число переноса катионов при отсутствии посторонних проводящих ток солей, то на 1 F электричества общая убыль концентрации ионов под действием тока составит (1 – n к) г-экв.
Таим образом, в начальный момент пропускания тока скорость убыли концентрации v 1 в прикатодном слое будет равна
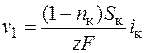 . (1.41)
. (1.41)
Как показывает опыт, убыль концентрации на границе фаз гетерогенной реакции непременно будет пополняться за счет диффузии, скорость которой можно выразить, исходя из первого закона Фика
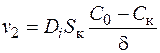 . (1.42)
. (1.42)
Здесь d– толщина диффузного слоя, т.е. расстояние между поверхностью катода, где концентрация разряжающихся ионов С к, и ближайшей к ней точкой раствора, характеризующейся неизменной концентрацией С 0.
Изменение концентрации вещества вблизи катода должно привести к изменению потенциала электрода.
Плотность тока при этом равна
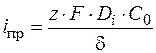 . (1.43)
. (1.43)
Отсюда получим уравнение концентрационной поляризации для катодного процесса
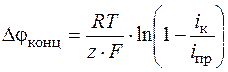 . (1.44)
. (1.44)
При прочих постоянных условиях предельная плотность тока пропорциональна начальной концентрации (точнее активности) разряжающихся ионов.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 402; Нарушение авторских прав?; Мы поможем в написании вашей работы!