
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимическая термодинамика и кинетика
|
|
|
|
В простейшем случае под термином электрод подразумевается металл, находящийся в электрическом контакте с электролитом. Электролит и металл отличаются типом проводимости.
Тип проводимости определяется типом носителей заряда, который переносится в электрическом поле. Проводимость металла – это электронная проводимость. Основными носителями заряда являются электроны. Проводимость в растворе электролита – ионная, поскольку основными носителями зарядов являются ионы. Ионный тип проводимости может осуществляться и в твердом теле, например в поверхностных пленках электродов различной природы. Электронной проводимости в растворах электролитов, как правило, не существует за исключением очень специальных случаев существования сольватированных электронов в растворах.
Ион по-гречески означает «странник» (предложено М. Фарадеем).
Электрод – это система последовательно включенных фаз, в которых одна (конечная фаза) представляет собой металл или полупроводник, а другая – электролит. Продукт электродной реакции называется избыточной фазой.
К полупроводникам относятся вещества, величина электропроводности которых занимает промежуточное положение между электропроводностью металлов и изоляторов. На поверхности металла в контакте с электролитом могут находиться пленки различной природы (солевые, оксидные и др.), в которых может осуществляться как электронная так ионная проводимость. Могут быть такие случаи, когда эти пленки будут иметь полупроводниковую природу.
Между металлом и электролитом, составляющими электрод, всегда возникает разность потенциалов. Она носит название напряжения электрода. Если это напряжение измерено по отношению к какому-то другому электроду, то такая разность потенциалов носит название – электродный потенциал.
Падение напряжения ячейки, элемента – это разность потенциалов между конечными металлическими фазами этой ячейки. Между разными металлами возникает контактная разность потенциалов.
Напряжение ячейки аддитивно складывается из скачков потенциалов на различных фазах. Потенциал отдельного электрода может быть измерен только по отношению к какому-то электроду сравнения и соответственно характеризуется напряжением этой цепи. В качестве таких электродов используются стандартные электроды сравнения. Более подробно электроды сравнения буду рассмотрены ниже.
Для возникновения разности потенциалов между двумя фазами необходим несбалансированный перенос зарядов (ионов или электронов) из одной фазы в другую. Направление такого переноса зависит от энергетических характеристик каждой из фаз. При равновесном потенциале перенос из одной фазы в другую по данным внешнего баланса прекращается. В действительности он не прекращается никогда, просто скорость прямого процесса становится равной скорости обратного.
При помещении медной пластины в раствор CuSO4через определенное время возникает равновесие, при котором скорость прямого процесса (восстановление меди до металла) равна скорости обратного процесса (окисления меди, ее растворения)
Cu+2 +2 
 Cu. (1.23)
Cu. (1.23)
При равновесном потенциале одновременно осуществляется два условия:
1) на фазовой границе отсутствуют электрохимические или химические превращения;
2) потенциал самопроизвольно переходит к одной и той же величине, если его изменять как от более высокого, так и от более низких значений.
Два этих условия одновременно означают отсутствие тока в системе. Виды равновесных потенциалов.
Можно выделить следующие виды равновесных потенциалов:
1) электрод металл – ионы металла
Cu  Cu+2 +2
Cu+2 +2  ; Zn
; Zn  Zn +2 +2
Zn +2 +2  . (1.24)
. (1.24)
В этом случае (1.24) в равновесии с металлической фазой находятся ионы металла, из которого состоит эта фаза.
2) окислительно-восстановительный (redox) электрод
Fe+2  Fe+3; 2H+ +2
Fe+3; 2H+ +2 
 H2
H2  . (1.25)
. (1.25)
В этом случае (1.25) в равновесии находятся ионы (молекулы) в различной степени окисления, а металлический электрод (платина, золото и.т.д.) играет роль только переносчиков электронов.
3) потенциал Донана или мембранный потенциал.
Мембранный потенциал образуется двумя фазами, содержащими различные ионы, причем по меньшей мере один из них способен переходить через границу, а для другого такой переход затруднен. Природа затруднения – механическая (полупроницаемая мембрана) либо химическая (вследствие ионного обмена).
Напряжение электрохимической ячейки U эл складывается из суммы скачков потенциалов на межфазовых границах на катоде
/-Δφк/ и аноде /Δφа/, характеризующих их поляризацию в данном электролите, заполняющем межэлектродный зазор (рис. 1.6).
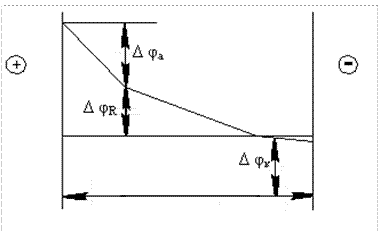
Рис. 1.6. Падение напряжения на межфазовых границах электродов
в электрохимической ячейке
Распределение напряжения в межэлектродном промежутке будет
U эл = (+Δφa) + (–Δφк) + Δφк, B. (1.26)
Если предположить, что распределение электропроводности электролита в межэлектродном промежутке а, то омическое сопротивление R по его сечению будет
R = a /(ӕ· S a), Ом, (1.27)
где а – межэлектродный промежуток;
S a – площадь анода.
Отсюда
Δφк = I·R = Ia/(ӕ· S a), (1.28)
так как  , тогда
, тогда
Δφк = I a· а /ӕ, B. (1.29)
Подставляя значение Δφк в уравнение, получаем
U эл = (+Δφa) + (–Δφк) + I a· а /ӕ, B. (1.30)
откуда можно вычислить плотность анодного тока при ЭХО
 ӕ. (1.31)
ӕ. (1.31)
Рассмотрим далее образование двойного электрического слоя на границе электрод-раствор.
На границе раздела фаз происходит пространственное разделение зарядов и образование своеобразного микроконденсатора – двойного электрического слоя. Термин «двойной электрический слой» означает пространственное разделение двух слоев зарядов противоположного знака. Обычно этим термином пользуются также и для характеристики строения границы раздела между электродом и раствором, хотя структура этой границы является более сложной: двойные слои образуются целиком и в металле, и в поверхностном слое ориентированных диполей растворителя, и в результате различной адсорбции ионов противоположного знака.
Первый пример характеризует возникновение ионного двойного слоя при погружении электрода в раствор его потенциалопределяющих ионов, например при погружении пластинки серебра в раствор, содержащий ионы Ag+. Если концентрация ионовAg+ выше той, которая отвечает нулевому раствору, то при установлении электрохимического равновесия часть ионов серебра перейдет из раствора на металл, в результате чего на электроде появится некоторый положительный заряд q (в расчете на единицу поверхности). В результате электростатического притяжения к электроду подойдет соответствующее количество анионов, а концентрация катионов вблизи поверхности, наоборот, уменьшится. Если концентрация потенциалопределяющих ионов будет ниже той, которая соответствует нулевому раствору, то после установления электрохимического равновесия электрод будет нести отрицательный заряд (q < 0), притягивать к себе катионы и отталкивать анионы. В нулевом растворе q = 0. Поэтому потенциал электрода в нулевом растворе, измеренный против какого-либо постоянного электрода сравнения, называют потенциалом нулевого заряда φ0 и обозначают Eq = 0.
Второй пример образования двойного электрического слоя относится к системам, в которых заряды не могут свободно переходить через границу между электродом и раствором. Электроды в таких системах называются идеально поляризуемыми электродами. В отличие от идеально поляризуемых электроды в системах, рассмотренных в первом примере, называются неполяризуемыми электродами. Простейший пример электрода, приближающегося по своим свойствам к идеально поляризуемому– это ртутный электрод в водном растворе фторида натрия (NaF). При помощи внешнего источника тока можно изменять потенциал этого электрода и с очень хорошим приближением полагать, что весь ток идет на изменение заряда поверхности ртути. Лишь при больших анодных потенциалах будет наблюдаться растворение ртути, а при больших катодных – разрядов ионов Na+ с образованием амальгамы натрия. В интервале между этими крайними потенциалами который составляет около 2 В, плотность заряда ртутного электрода принимает различные – сначала положительные, а затем отрицательные – значения. В частности, при некотором потенциале q = 0.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 91; Нарушение авторских прав?; Мы поможем в написании вашей работы!