
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы Фарадея
|
|
|
|
М. Фарадей установил количественную связь между прошедшим через фазовую границу электричеством и количеством вещества, претерпевающим те или иные химические изменения на границе.
Для электрохимических процессов, протекающих на границе проводников первого и второго рода, естественно применимы законы сохранения вещества и энергии. Закон сохранения вещества применительно к электрохимическим превращениям на электродах принимает форму двух хорошо известных законов Фарадея:
1) количество вещества, прореагировавшего на электроде при пропускании постоянного электрического тока, пропорционально силе тока и времени электролиза;
2) при постоянном количестве пропущенного через электрод электричества масса выделившегося вещества пропорциональна химическому эквиваленту этого вещества.
Оба этих закона можно объединить следующим выражением
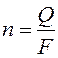 , (1.46)
, (1.46)
где n – число грамм-эквивалентов вещества, вступившего в электрохимическую реакцию при пропускании через границу раздела фаз Q кулонов электричества;
F = 96485 Кл/г-экв – число Фарадея.
Так как течение электрохимических реакций связано с переходом электричества, то для любой электрохимической системы можно написать выражение для работы электрического тока
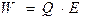 , (1.47)
, (1.47)
где Q – фактор емкости;
Е – фактор интенсивности.
Следовательно, здесь имеются две группы закономерностей. Первая группа связана с прохождением некоторого количества электричества через границы катод – электролит Q к, анод – электролит Q аи собственно электролит Q э
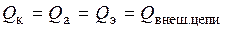 , (1.48)
, (1.48)
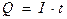 , (1.49)
, (1.49)
где I – сила тока, А;
t – время, сек.
Выражая работу электрического тока через количественный фактор Q и фактор интенсивности Е, можно определить электрические единицы следующим образом.
Единица силы тока – ампер (А) есть сила неизменяющегося тока, который, будучи поддерживаем в двух параллельных прямолинейных проводниках бесконечной длины ничтожно малого круглого сечения, расположенных на расстоянии 1 м один от другого в пустоте.
Единица работы – джоуль (Дж) представляет работу, производимую силой в 1 Н на пути в 1 м при совпадении направлений силы и перемещения точки приложения силы.
Единица количества электричества – кулон (Кл), или ампер-секунда (А·сек), есть количество электричества, протекающее через поперечное сечение проводника в течение 1 сек при неизменяющейся токе в 1 А. Количество электричества и электрический заряд имеют одинаковую размерность.
Вторая группа закономерностей относится к фактору интенсивности Е и связана со скачками потенциалов на границе катод – электролит.
Электрохимический эквивалент – количество граммов вещества (элемента), выделившегося при прохождении единицы количества электричества. На практике его чаще относят не к постоянной Фарадея, а к одному ампер-часу. Согласно закону Фарадея, электрохимические эквиваленты пропорциональны химическим эквивалентам.
Ниже представлены данные атомных масс и электрохимических эквивалентов (табл. 1.4).
Таблица 1.4
Атомные массы и электрохимические эквиваленты
| Элемент | Атом. масса, A | Степень окисления, Z | Электрохими-ческий эквивалент, αэ, г/А·мин | αv,мм/А·мин | αn,мм/А·мин |
| Алюминий | 26,98 | 0,0056 | 2,07 | 0,0207 | |
| Железо | 55,84 | 0,0174 | 2,20 | 0,0220 | |
| 0,0115 | 1,46 | 0,0146 | |||
| Кобальт | 58,33 | 0,0126 | 1,44 | 0,0144 | |
| Никель | 58,71 | 0,0182 | 2,06 | 0,0206 | |
| Хром | 51,99 | 0,0108 | 1,52 | 0,0152 | |
| Титан | 47,40 | 0,0148 | 3,30 | 0,0330 |
Электрохимический эквивалент сплава рассчитывается по формуле
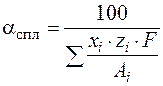 , (1.50)
, (1.50)
где χ i – процентное содержание химического элемента в сплаве;
zi – степень окисления химического элемента в сплаве;
Аi – атомная масса химического элемента в сплаве;
F – число Фарадея (F = 96500 Кл =26,8 A/ч).
Объемный электрохимический эквивалент сплава определяется следующим образом
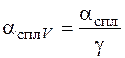 , (1.51)
, (1.51)
где γ – плотность сплава.
На практике наблюдаются отклонения от законов Фарадея, так как на электродах и в объеме электролита может происходить отклонение от законов Фарадея.
Причинами кажущихся отклонений от закона Фарадея могут быть:
1. неустойчивость химического состава конечных продуктов;
2. диспергирование выделяющегося металла в виде металлического тумана;
3. саморастворение анодов;
4. дезинтеграция электрода;
5. некорректность определения или незнание степени окисления металла.
Отклонение от законов Фарадея влияют на выход по току при электролизе и характеризуют полезное использование тока:
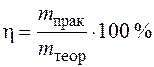 , (1.52)
, (1.52)
где m практ – масса продукта, выделившегося при пропускании определенного количества электричества;
m теор– масса продукта, которая должна была выделиться по закону Фарадея.
При экспериментально определенном выходе по току массу металла, снимаемого с анода, можно определить по формуле
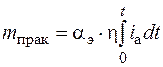 , (1.53)
, (1.53)
где αэ – электрохимический эквивалент металла;
η – выход по току.
Выход по току η позволяет определить ту часть количества протекающего электричества, которая приходится на долю электродной реакции. Анодный выход по току, определяемый гравиметрическим способом, служит одной из характеристик обрабатываемости материалов. Однако корректное определение этого значения требует установления, в какой степени окисления переходит данный металл в раствор. Необходимо также установить, является ли процесс ионизации равномерным или селективным. В ряде случаев, определяя степени окисления иона в растворе, нельзя с полной уверенностью сказать, что ионизация в электрохимической стадии произошла в данной степени окисления. В самом определении анодного выхода по току гравиметрическим методом может закрасться ошибка, так как наряду с ионизацией на аноде может происходить окисление с образованием пассивирующей пленки или фазовой пленки, которую отделить от металла достаточно трудно.
Повышенные значения выхода по току (более 100 %) могут быть обусловлены рядом причин: неправильным определением степени окисления иона компонента, образующегося в результате электрохимического окисления; дезинтеграции. Так, например, анодные выходы для алюминия и его сплавов, бериллия и его сплавов, хромистых сплавов больше 100 % (если рассчитывать это, значение для максимальной степени окислений (А13+, Ве2+, Сг6+).
Установлено, что при анодной обработке материалов на основе титана, бериллия, алюминия, хрома: ионизация осуществляется образованием низковалентных ионов (Тi3+, Ве+, Аl+, Cr3+) и частично ионов в более высокой степени окисления. Поэтому расчет выхода по току весьма затруднителен для данных материалов. Низковалентные ионы химически окисляются протонами воды или анионами и в растворе, поэтому в растворе мы можем зафиксировать лишь более устойчивые степени окисления для данных металлов.
Аномальной величиной выхода по току обусловлены также селективность ионизации, при наличии которой определение общего расхода по сплаву не представляется возможным. Анодное растворение электроотрицательных компонентов контролируется его нестационарной диффузией из объема сплава к поверхности. Так, например, при поляризации высокими плотностями тока порошковых материалов из компонентов с весьма отличными электрохимическими свойствами ионизируется электрохимически активный компонент. Например, вольфрам растворяется при ионизации W-Сu, а медь в виде порошка накапливается на поверхности.
Аномальные высокие выходы по току могут наблюдаться при дезинтеграции, т.е. механическим выпадении каких-либо частиц, слабо связанных с матрицей сплаве.
Наиболее надежные данные можно получить, определяя парциальные выходы по компонентам, так как общие выход по сплаву объективно корректно определить трудно, что в ряде случаев и способствует получению весьма противоречивых данных у различных исследователей.
Увеличение выхода по току с возрастанием плотности тока объясняется по-разному, Возможно, что при увеличении плотности тока уменьшается рН прианодного слоя и анодная пассивирующая пленка растворяется. В связи с увеличением температуры анода при повышения плотности тока происходит активация поверхности. При высоких значениях потенциала, положительнее потенциала выделения кислорода, наблюдается активирование анода (анодно-анионная активация), так как происходит адсорбционное вытеснение пассивирующих ионов активирующими ионами.
Объем растворенного при ЭХО металла V 0 (см3) рассчитывают по формуле:
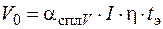 , (1.54)
, (1.54)
где I – сила тока, проходящего через электролит, А;
t э– время электролиза, мин.
Скорость анодного растворения определяется выражением
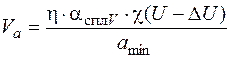 , (1.55)
, (1.55)
где η – выход по току материала заготовки;
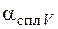 – объемный электрохимический эквивалент сплава, см3/А·мин;
– объемный электрохимический эквивалент сплава, см3/А·мин;
χ – удельная электропроводность электролита, Ом–1·см–1;
U – напряжение на электродах, В;
Δ U – суммарная поляризация электродов, В;
a min– минимальный межэлектродный зазор, см.
Для поддержания скорости съема металла с заготовки необходимо иметь скорость потока, достаточную для выноса из промежутка всех продуктов обработки. Сначала вычисляют скорость электролита 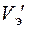 , которая могла бы обеспечить полный унос продуктов анодных и катодных реакций из указанного пространства, затем скорость
, которая могла бы обеспечить полный унос продуктов анодных и катодных реакций из указанного пространства, затем скорость 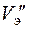 , которая исключила бы в нем недопустимый перегрев электролита.
, которая исключила бы в нем недопустимый перегрев электролита.
Скорость электролита определяется по формуле
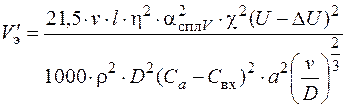 , (1.56)
, (1.56)
где k – безразмерный коэффициент (k = 4,64);
ν – кинематическая вязкость электролита в пределах диффузионного слоя, мм2/с (ν = 1,2…1,8 мм2/с,);
lp – длина обрабатываемой поверхности заготовки в направлении потока электролита, мм;
ρ – плотность продуктов обработки, кг/м3 (ρ = 2500…3000 кг/м3);
D – коэффициент диффузии, применяется в зависимости от концентрации электролита и его температуры, мм2/с (D =1,3·10–3мм2/с);
С – массовая концентрация продуктов обработки (С a – в зазоре на аноде, (С a = 0,92…0,97); C вх – на входе в зазор в электролите (C вх = 0,002…0,005).
Скорость, исключающая перегрев электролита, определяется следующим образом
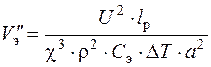 , (1.57)
, (1.57)
где U – напряжение на электродах, В;
lp – длина обрабатываемой поверхности в направлении течения электролита, см;
Δ T – допустимый нагрев электролита, определяется точностью ЭХО. На практике Δ T =5…10°С. Для небольших по длине поверхностей принимается меньшее значение Δ T;
ρэ – плотность электролита, г/см3 (ρэ = 1,06…1,12 г/см3);
С э – теплоемкость раствора электролита (С э =4,18 Дж/гºC).
ГЛАВА 2. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
ЭЛЕКТРОЭРОЗИОННОЙ ОБРАБОТКИ
2.1. Сущность, классификация и кинематика процессов
электроэрозионной обработки
Сущность метода. Электроэрозионная обработка (ЭЭО) заключается в изменении формы, размеров, шероховатости и свойств поверхности заготовки под воздействием электрических разрядов в результате электрической эрозии (ГОСТ 25331-82). Схема ЭЭО приведена на рис. 2.1.
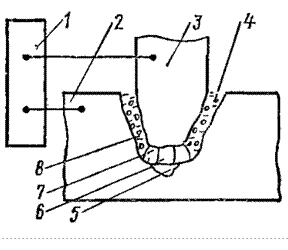
Рис. 2.1. Схема ЭЭО:
1 – генератор импульсов; 2 – заготовка; 3 – ЭИ; 4 – капли расплавленного металла;
5 – эрозионная лунка; 6 – плазменный канал разряда; 7 – газовый пузырь; 8 – РЖ
Электрический разряд – высококонцентрированный в пространстве и во времени импульс электрической энергии, преобразуемой между электродом-инструментом (ЭИ) и электродом-заготовкой в тепловую. При этом в канале разряда протекают нагрев, расплавление и испарение материала с локальных поверхностей электродов, ионизация и распад рабочей жидкости (РЖ).
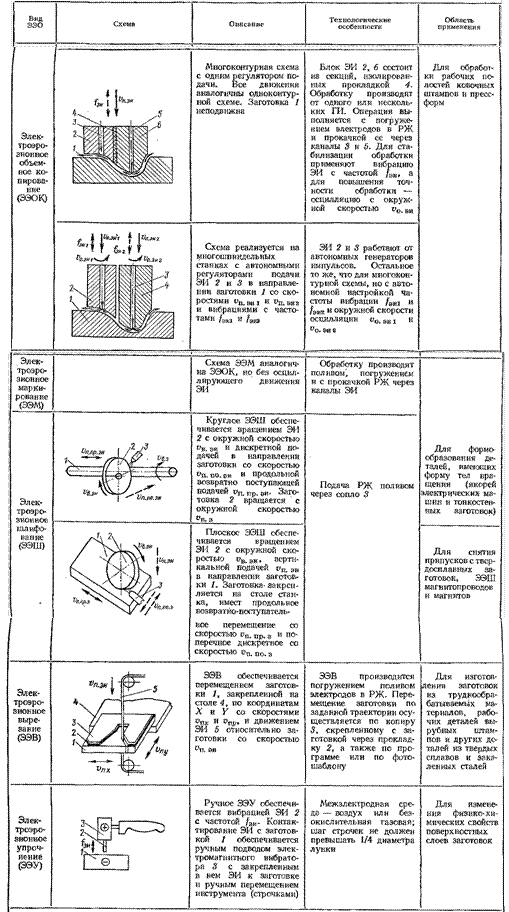
Классификация ЭЭО. В соответствии с технологическими признаками (ГОСТ 25331-82) установлены следующие виды ЭЭО (табл. 2.1): отрезка (ЭЭОт); объемное копирование (ЭЭОК), вырезание (ЭЭВ), прошивание (ЭЭПр); шлифование (ЭЭШ); доводка (ЭЭД); маркирование (ЭЭМ) и электроэрозионное упрочнение (ЭЭУ). Определены разновидности комбинированной ЭЭО, например электроэрозионно-химическая (ЭЭХО), электроэрозионно-абразивная и анодно-механическая обработка.
Таблица 2.1
Классификация основных видов ЭЭО

Продолжение табл. 2.1
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 163; Нарушение авторских прав?; Мы поможем в написании вашей работы!