
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поляризация и перенапряжение
|
|
|
|
При проведении измерений прибором с высоким входным сопротивлением (например, мостом постоянного тока или ламповым вольтметром) и вольтметром с низким входным сопротивлением мы получим разные значения напряжений. Если в системе протекает ток, то потенциал будет смещаться от равновесного значения (рис. 1.7). В. Нернстом было введено понятие перенапряжения. Перенапряжение h определяется как разность между потенциалом под током j(i) и равновесным потенциалом, который определяется по уравнению В. Нернста. Потенциал под током всегда будет отличаться от равновесного значения jр, причем чем больше будет величина проходящего тока, тем больше будет отличие (и наоборот).
Таким образом, можно записать
 , (1.45)
, (1.45)
где h– перенапряжение.

Рис. 1.7. Изменение потенциала электрода под током
Разница между потенциалом под током и потенциалом обесточенного электрода называется поляризацией. Зависимость тока (плотности тока) от потенциала или перенапряжения называется поляризационной зависимостью. Обычно эта зависимость нелинейная.
Для того чтобы измерить потенциал (перенапряжение) необходимо измерить потенциал под током или ток при определенном потенциале. Приборы, которые позволяют осуществить подобные измерения, называются потенциостатами (гальваностатами). При использовании потенциостатического метода измерений задается потенциал электрода относительно стандартного электрода сравнения и измеряется ток (плотность тока) рабочего (исследуемого) электрода. Такой метод называется потенциостатическим. Возможен и другой метод, при котором задается ток (плотность тока), а измеряется потенциал. Такой метод называется гальваностатическим. В том случае, когда потенциал или ток электрода изменяются с определенной скоростью, метод измерений носит название потенциодинамического (гальванодинамического) метода.
|
|
|
Очевидно также, что и потенциостатический и гальваностатический методы можно использовать только при применении трехэлектродной ячейки. Один из электродов при этом является рабочим (анодом или катодом), а другой – электродом сравнения (водородный, хлорсеребряный, каломельный и др.). Третьим же электродом является вспомогательный электрод, обеспечивающий прохождение тока через ячейку. При этом разница потенциалов под током между рабочим электродом и электродом сравнения измеряется прибором с высоким входным сопротивлением (высокоомным вольтметром). Это означает, что ток в цепи рабочего электрода и электродов сравнения пренебрежимо мал по сравнению с током между рабочим электродом и вспомогательным. Меняя ток или потенциал между рабочим электродом и электродом сравнения (вспомогательным электродом) и измеряя ток (потенциал), можно получить зависимость плотности тока от перенапряжения, т.е. зависимость скорости электродной реакции и соответственно скорости, например, электрохимической обработки от потенциала.
Сам электрохимический процесс состоит из нескольких стадий, однако, как правило, только одна из стадий (самая медленная) определяет скорость реакции. Такая стадия носит название лимитирующей. Именно она определяет общую скорость электрохимического процесса.
Чтобы увеличить скорость процесса необходимо, прежде всего, воздействовать на лимитирующую стадию.
В электрохимических процессах лимитирующими могут быть следующие стадии:
1. Стадия перехода (переноса заряда).
2. Стадия химической реакции (которая предшествует или следует после стадий переноса заряда).
3. Стадия диффузии (конвективной диффузии) – подвод или отвод реагента (продуктов реакции) от (к) поверхности электрода.
|
|
|
4. Стадия кристаллизации (при электроосаждении или образовании кристаллических анодных пленок).
5. Стадия адсорбции.
Если какая-либо из этих стадий будет определять скорость всей (общей) реакции, то тогда перенапряжение будет определяться этой стадией. Поэтому для стадии 1 – это перенапряжение перехода (переноса заряда). Для стадии 2 – это перенапряжение реакции. Для стадии 3 – это перенапряжение диффузии. Соответственно перенапряжение кристаллизации и адсорбционное перенапряжение. Сумма перенапряжений реакции и диффузии (конвективной диффузии) носит название концентрационного перенапряжения.
Анодное перенапряжение, как и катодное, увеличивается с ростом плотности тока. Те металлы, которые характеризуются малым перенапряжением при катодном выделении (велик ток обмена), соответственно обладают и малой анодной поляризацией и, наоборот, металлы, отличающиеся при катодном восстановлении малым током обмена, имеют большую анодную поляризацию.

Рис. 1.8. Общая поляризационная кривая
В процессе анодной поляризации металлы могут находиться в активном (участок АБ) и активированном (участок ОЕ) состояниях, в переходном состоянии – участок БВ, в состоянии пассивации (участок ВО), транспассивации (участок ОД). На участке ОК происходит выделение кислорода на пассивированной поверхности, вследствие разряда воды (рис. 1.8).
Активное анодное растворение. При положительном значении от равновесного потенциала металл может активно анодно поляризоваться рис. 1.8 (участок АБ). В этой области происходит травление металла, поэтому шероховатость поверхности значительна.
Процесс растворения материалов начинается при сравнительно небольшой величине анодного потенциала, близкого к стационарному значению потенциала обеспеченного электрода. По мере увеличения потенциала в его области протекает активный процесс растворения. Для нее характерно изменение плотности тока в широких пределах при небольшом смещении анодного потенциала в ту или иную сторону. Физическую сущность активного растворения объясняют способностью некоторых анионов вытеснять адсорбированный кислород, разрушая тем самым пассивирующую пленку. Эти анионы называют активирующими. Разрушая окисную пленку, они принимают непосредственное участие в процессе анодного растворения металла, образуя с ним комплексное соединения. Одним из типичных представителей активирующих анионов является анион хлора. Примером являются стаи анодного растворения в активной области для железа, никеля и бериллия при поляризации в растворах хлорида натрия.
|
|
|
Ионизация никеля и железа происходит стадийно
 ,
,
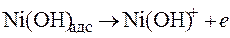 ,
,
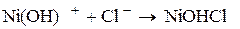 .
.
Активное анодное растворение может происходить в том случае, если анодные оксиды и гидроксиды хорошо растворимы.
При адсорбции анионов в первую очередь заполняются активные центры. Ряд анионов способен изменять распределение электрических зарядов внутри ионов металлов.
Скорость анодного растворения во многом определяется природой и концентрацией анионов, которые могут интенсифицировать или тормозить анодный процесс растворения. Повышение скорости анодного растворения наблюдается, если анионы, обладающие достаточным химическим сродством к металлу, образуют с его ионами промежуточное комплексы, слабо связанные с кристаллической решеткой. Активирующее действие анионов связано с замедлением процесса окисления поверхности, вследствие вытеснения ими адсорбированной воды и гидроксил-ионов с поверхности металла. Торможение процесса анодного растворения происходит, если анионы, адсорбируясь на поверхности, образуют прочные адсорбционные пленки, препятствуя дальнейшей ионизации. Некоторые анионы, выступая в качестве акцепторов электронов, увеличивают скорость переноса катионов и способствуют росту пленки. При наложении высокой плотности тока активное растворение тормозится в результате образования на поверхности адсорбционного слоя кислорода, оксидных слоев, вследствие адсорбции воды. Образование барьерного слоя происходит мгновенно, так как этот процесс лимитируется только переносом протонов от адсорбированных молекул воды к ближайшим молекулам в растворе.
|
|
|
Необходимо отметить, что, как показывают многочисленные экспериментальные данные, растворение металлов в активной области, как правило, протекает со 100 % выходом по току по устойчивым в данном растворе низшим степеням окисления, за исключением случаев, когда большие значения выхода по току связаны с дезинтеграцией отдельных фазовых составляющих сплавов.
Электрохимическая обработка, осуществляемая в тафелевской области (активное растворение), является энергетически выгодной, так как при сравнительно небольших значениях потенциалов на поверхности электрода возможно достигнуть больших плотностей тока. Кроме того, обработка в таких условиях позволяет получить большую точность изготовления деталей машин.
При потенциалах точки В реакция анодного растворения может тормозиться вследствие образования поверхностных слоев – пассивации (участок ВО, рис. 1.8). Пассивация – торможение процесса анодного растворения, вследствие образования адсорбционных или фазовых слоев оксидов или солей. Образование поверхностного солевого слоя и предельно высокой концентрации раствора у поверхности электрода, способствует наступлению пассивации. При пассивации достигается экранирование определенной части активных центров вследствие посадки на них окислителя (кислорода) и образования прочных связей химического типа.
Основные особенности растворения металлов в этой области потенциалов связаны с изменениями плотности тока и выхода метала по току по мере увеличения анодного потенциала.
Анодное растворение в транспассивной области. Эту область анодного растворения (участок ОД, рис. 1.8) – область второго подъема тока на поляризационной кривой – называют областью транспассивного растворения, или перепассивации. Наиболее общими характерными признаками процесса принято считать ускорение реакции электрохимического растворения, происходящее в результате нарушения пассивного состояния поверхности анода. Под пассивностью понимается повышенная способность металла вызывать торможение анодной реакции в условиях, когда она с термодинамической точки зрения вполне реакционноспособна. При этом сдвиг потенциала электрода в положительную сторону вследствие воздействия сильной окислительной среды или поляризации.
Согласно пленочной или адсорбционной теории поведение металла определяется свойствами фазовой пленки образующейся в окислительных средах при взаимодействии с кислородосодержащими анионами и покрывающей поверхность анода. Поверхностные окисные слои могут быть различной природы. В ряде случаев они требуют высоких значений анодных потенциалов для их пробоя и начала растворения (при обработке титана) причем в отсутствии определенных активирующих по отношению к данному процессу анионов.
Адсорбционная теория предполагает образование окисных соединений металла с адсорбированным на его поверхности кислородом который с одной стороны может блокировать активные места растворяющейся поверхности с другой – образует на поверхности адсорбционные слои, изменяющие строение двойного слоя и смещающие потенциал анода в положительную сторону. Следствием этого являются повышение энергии необходимой для ионизации металла и торможение реакции растворения.
Пассивация электрода возникает также в результате диффузионных ограничений процесса растворения поскольку увеличение подводимой энергии при этом не приводит к росту плотности тока.
Анализ закономерностей кинетики анодного растворения металла позволяет описать несколько видов транспассивного растворения или активирования процесса растворения после достижения пассивного состояния поверхности электрода:
1. ускорение процесса растворения при потенциалах выше области пассивации, обусловленной ограничением скорости массопереноса, или так называемо «солевой пассивации»;
2. ускорение процесса ионизации металла в условиях, когда на пассивной поверхности электрода протекает реакция выделения кислорода (такой процесс наблюдается в электролитах, получивших в литературе название «пассивирующих» – нитратах и хлоратах);
3. ускорение процесса ионизации металла, наблюдаемое до потенциалов выделения кислорода в условиях пассивного состояния поверхности анода, обусловленного генерированием окислителя в процессе растворения хрома и сплавов хрома с никелем и железом никеля с вольфрамом и подобных;
4. ускорение процесса растворения, обусловленное разрушением фазовой окисной пленки, образующейся на поверхности таких металлов, как титан, ниобий и т.д.
В транспассивной области происходит переход в раствор металла в виде ионов с более высокими степенями окисления, чем в активной области, так, например, Cr, Mo,W, V, ионизируются в высшей степени окисления по реакциям:
2Cr + 7H2O → Cr2O  +14H+ + 12
+14H+ + 12 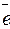 ,
,
Mo + 4H2O → MoO  + 8H+ + 6
+ 8H+ + 6 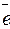 ,
,
W + 4H2O → WО  + 8H+ + 6
+ 8H+ + 6 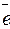 ,
,
V + 3H2O → VO  + 6H+ + 5
+ 6H+ + 5 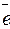 .
.
Механизм анодно-анионной активации. Нарушение пассивного состояния – активация металла рис. 1.8 (участок ОЕ), заключается в увеличении анодного тока при достижении критического значения потенциала, что обусловлено адсорбционным вытеснением активирующими анионами, например, Cl–, пассивирующих ионов, например, ОН–, с поверхности электрода. Образуются соединения между поверхностными атомами металла и активирующими анионами, которые переходят в раствор. На процесс адсорбции и вытеснения пассивирующих ионов оказывает влияние природа и концентрация активирующих ионов.
Активирующие ионы адсорбируются в дефектных местах оксидных пленок. Адсорбированные анионы мигрируют через оксидную пленку к металлу. Потенциал активации – это минимальный потенциал, при котором активные ионы приобретают способность вытеснять с электрода пассивирующий кислород на тех участках, где прочность связи кислорода с металлом меньше. При анодной поляризации изменяется поляризуемость ионов и создаются условия для вытеснения одних ионов другими.
Активирующие ионы, адсорбируясь на дефектах, вытесняя с поверхности оксида кислород, препятствуют утолщению пленки в дефектных местах и затрудняют процесс выделения кислорода. Часто поверхность, где произошла активация, увеличивается во времени и вся поверхность растворяется в активированном состоянии. Проникают анионы к металлу через оксидную пленку преимущественно через винтовые дислокации, в результате чего происходит превращение пассивирующего оксида в растворимое в электролите химическое соединение. Потенциалом анодно-анионной активации является потенциал, при котором устанавливается равновесие между оксидом и раствором соли.
В результате адсорбции активирующих анионов при положительных значениях потенциалов происходит постепенное утонение (вследствие ее растворения) оксидной пленки, что приводит к образованию питтингов. При увеличении концентрации адсорбирующихся ионов между ними увеличиваются силы взаимного отталкивания, что способствует появлению трещин, в которых адсорбируются новые порции анионов. Таким образом, в результате адсорбции активирующих анионов в анодной пленке создается критическое механическое напряжение. Анодная оксидная пленка под влиянием деформации разрушается. В результате адсорбции анионов может измениться также тип проводимости пленок.
При определенном потенциале наступает предельный ток i пр, при котором реализуются диффузионно-миграционные ограничения по отводу от поверхности электрода образующихся в растворе ионов растворяемого металла. Устранение солевой пассивации может обеспечиваться интенсивным перемешиванием. При дальнейшей поляризации солевая пленка исчезает и происходит увеличение скорости ионизации металла, при этом одновременно выделяется кислород. Скорость процесса в данной области определяется условиями массопереноса в приэлектродном слое раствора.
В прианодном слое всегда происходит закисление, т.е. значительное снижение рН раствора, что способствует проявлению окислительно-восстановительных процессов с участием анионов-окислителей:
1. Анионы-окислители могут способствовать пассивации.
2. Анионы-окислители могут участвовать в дополнительном химическом окислении низковалентных частиц. Однако, в том случае, если после анодной поляризации образуется барьерный слой, окисление низковалентных частиц в наибольшей мере происходит электрохимически, по мере движения иона через барьерный слой.
3. Роль окислителей может заключаться в окислении низковалентных оксидов до более высокой степени окисления
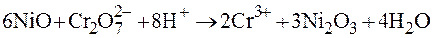 ,
,
которые, являясь нестабильными, разрушаясь, переходят в раствор по реакции
 .
.
4. Адсорбция окислителя при потенциалах, положительнее потенциала выделения кислорода, способствует анодно-анионной активации.
Анионный состав солевого электролита оказывает существенное влияние на характер зависимостей U – i, φ – i, η – i, V a – a. В зависимости от природы анионов в электролите анодное растворение происходит при потенциалах активации, транспассивации, анодно-анионной активации.
|
|
|
|
|
Дата добавления: 2017-02-01; Просмотров: 245; Нарушение авторских прав?; Мы поможем в написании вашей работы!