
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса
|
|
|
|
Понятие о термохимии.
Термохимия. Закон Гесса. Термохимические уравнения.
Раздел химической термодинамики, посвященный исследованиям тепловых эффектов химических реакций, теплотам фазовых переходов, теплотам растворения веществ, разбавления растворов и т.д., называется термохимией. Значение термохимии в области теории и практики велико: тепловые эффекты используются не только при расчете тепловых балансов различных процессов, но и при исследовании химического равновесия.
При химических реакциях происходит изменение внутренней энергии, так как в ходе реакции связи в исходных веществах разрушаются и образуются новые связи в продуктах реакции с другой энергией. Изменение внутренней энергии при химических реакциях может происходить только путем теплообмена (поглощения или выделения теплоты) и совершения работы. Работа химических реакций невелика и ее можно вычислить. Теплоты же реакций бывают значительными и их необходимо учитывать при проектировании установок и при работе в лаборатории.
Раздел химической термодинамики, задача которого состоит в определении тепловых эффектов химических процессов и установления закономерностей в их величинах, называют термохимией.
В химии чаще совершаются процессы при постоянном давлении, чем при постоянном объеме. Если при этом совершается только работа расширения (Р = const), то первый закон термодинамики можно записать
 , (2.55)
, (2.55)
или в интегральной форме
 (2.56)
(2.56)
где ∆ rH – изменение энтальпии реакции (по сути разность между суммой энтальпий продуктов реакции и суммой энтальпий исходных веществ).
Если реакция проводится при постоянном объеме (V = const), то
 , (2.57)
, (2.57)
где ∆ rU – изменение внутренней энергии реакции.
Теплоту QP, выражаемую соотношением (2.56), называют тепловым эффектом реакции при постоянном давлении или энтальпией реакции; а теплоту QV, выражаемую соотношением (2.57), – тепловым эффектом реакции при постоянном объеме.
В термохимии вместо понятия «теплота химической реакции» используют понятие «тепловой эффект химической реакции», причем эти термины не тождественны. Под тепловым эффектом химической реакции понимают теплоту, которая выделяется или поглощается в ходе процесса при выполнении следующих условий:
а) процесс протекает необратимо при постоянном давлении или постоянном объеме;
б) в системе не совершается никаких работ, кроме работы расширения;
в) продукты реакции имеют ту же температуру, что и исходные вещества.
Поскольку внутренняя энергия и энтальпия являются функциями состояния, то тепловой эффект химической реакции не зависит от пути ее протекания (промежуточных стадий), а определяется лишь начальным и конечным состоянием системы (то есть состояниями исходных веществ и продуктов реакции). Приведенное следствие первого закона термодинамики применительно к химическим процессам называется законом Гесса и является основным законом термохимии.
В формулировке Гесса в 1836 году этот закон звучал следующим образом: если из данных исходных веществ можно получить заданные конечные продукты разными путями, то суммарная теплота процесса (при V = const или при P = const) на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, то есть не зависит от пути перехода от исходных веществ к продуктам реакции.
Далее, можно записать, что при V = const
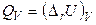 ,
,
а при P = const
 .
.
Таким образом, при условии, что  , получаем
, получаем
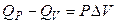 , (2.58)
, (2.58)
т.е. разность тепловых эффектов при постоянном давлении и постоянном объеме равна работе расширения (сжатия) системы при завершении изобарно-изотермической реакции.
Пусть в системе протекает реакция
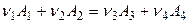 ,
,
где А 1, А 2 – исходные вещества; А 3, А 4 – продукты реакции;
νi – стехиометрические коэффициенты.
Если все Аi – идеальные газы, то при T = const

где ∆ ν = (ν 3 + ν 4) – (ν 1 + ν 2). Подставив  в уравнение (2.58), получим
в уравнение (2.58), получим
 . (2.59)
. (2.59)
Cоотношение (2.59) будет выполняться и для реальных газов при невысоких давлениях. Если в реакции кроме газов участвуют твердые или жидкие вещества, то при вычислении ∆ ν учитываются стехиометрические коэффициенты только при газообразных веществах. Для реакции с веществами только в конденсированном состоянии ∆ ν ≈ 0 и QP ≈ QV.
В химической термодинамике и технологии чаще рассматриваются изобарные процессы, для которых QP = ∆ H. Поэтому термин «тепловой эффект химической реакции» заменяют термином «энтальпия реакции», понимая под последним изменение энтальпии при протекании химической реакции.
Энтальпия реакции ∆ r H может быть больше нуля (∆ r H > 0) – такие реакции называются эндотермическими реакциями (с поглощением теплоты), и меньше нуля (∆ r H < 0) – такие реакции называются экзотермическими реакциями (с выделением теплоты).
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 478; Нарушение авторских прав?; Мы поможем в написании вашей работы!