
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термохимические уравнения
|
|
|
|
В термодинамике при написании химического уравнения принято включать в него тепловой эффект реакции. Такая запись называется термохимическим уравнением. Тепловой эффект реакции определяется не только природой реагирующих веществ, на и их агрегатным состоянием. В связи с этим в термохимическом уравнении через символы (г), (ж), (т) или (к) обозначаются соответственно газообразное, жидкое, твердое или кристаллическое состояние. Некоторые примеры записи термохимических уравнений:
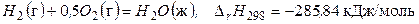 (а)
(а)
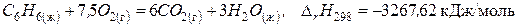 (б)
(б)
Размерность теплового эффекта энергия / количество вещества (Дж/моль) связана с новым в СИ определением физической величины – количеством вещества и его единицей – молем. Согласно этому определению тепловой эффект химической реакции можно относитьк любому из исходных веществ или продуктов реакции или ко всем реагентам. Например, для реакции (а) тепловой эффект относится к 1 молю Н 2 О (ж), или к 1 молю Н 2 (г), или 0,5 моль О 2 (г). Однако к какому бы из участников ни относили Δ rH, эта величина характеризует реакцию в целом.
С термохимическими уравнениями, если тепловые эффекты приводятся в них при одних и тех же внешних условиях, можно оперировать точно так же, как с алгебраическими. В частности, их можно суммировать, вычитать одно из другого, умножать на постонные коэффициенты и т.д. Это свойство термохимических уравнений вытекает непосредственно из закона Гесса.
Например,
 (в)
(в)
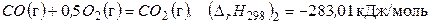 (г).
(г).
Вычитая из уравнения (в) уравнение (г), получаем
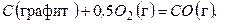 (д)
(д)
 .
.
Если тепловые эффекты реакций (в) и (г) могут быть определены с высокой степенью точности экспериментальным путем, то для реакции (д) его непосредственно измерить невозможно, поскольку эту реакцию в «чистом» виде провести нельзя (всегда наряду с СО при горении будет образовываться СО 2). Таким образом, закон Гесса позволяет вычислить тепловые эффекты тех реакций, для которых непосредственное определение теплового эффекта сопряжено с большими экспериментальными трудностями (или вообще избежать необходимости определять тепловые реакции некоторых реакций опытным путем).
Приведем еще один пример:
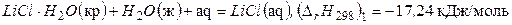

Тогда, вычитая из первого уравнения второе, получим


|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1301; Нарушение авторских прав?; Мы поможем в написании вашей работы!