
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе следствие.
|
|
|
|
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ.
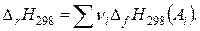
Под теплотой образования (энтальпией образования) понимают то количество теплоты, которое выделяется или поглощается при образовании 1 моля i-го вещества (атом, молекула, ион) из простых базисных веществ. Стандартные теплоты образования принято обозначать
 .
.
Теплота образования простых базисных веществ при стандартных условиях принимается равной нулю:
 для базисных веществ.
для базисных веществ.
В справочных таблицах обычно приводятся значения стандартных энтальпий образования соединений из простых базисных веществ в стандартных условиях с обозначениями
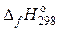 в расчете на 1 моль образованного вещества.
в расчете на 1 моль образованного вещества.
Стандартная теплота образования вещества зависит не только от его природы, но и от его состояния. Так, например, теплота образования
серы ромбической  ; серы моноклинной
; серы моноклинной 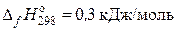 ;
;
серы газообразной  .
.
Приведем некоторые примеры:
Тепловой эффект реакции

соответствует теплоте образования газообразного хлора;
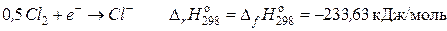
соответствует теплоте образования газообразного иона хлора;

соответствует теплоте образования иона хлора в бесконечно разбавленном водном растворе;
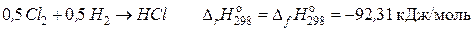
соответствует теплоте образования газообразного хлорида водорода;
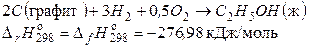
соответствует теплоте образования жидкого этанола.
Данные по стандартным теплотам образования позволяют рассчитать не только тепловые эффекты реакций, но и теплоты фазовых переходов и других физико-химических процессов. Например, для процесса испарения ацетона:
 ,
,  ,
,
 .
.
Закон Гесса можно использовать для расчета энтальпий самых разнообразных реакций, исходя из следующих соображений:
1) количество любого из элементов, входящих в структуры химических соединений, сохраняется в ходе реакций;
2) тепловой эффект реакции можно рассчитать, если провести мысленно реакции с начальными и конечными веществами до одних и тех же продуктов (рис. 2.2).
В соответствии со схемой:
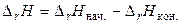 .
.
Если продукты, полученные в реакциях с участием начальных и конечных веществ, являются:
а) простыми веществами, то величины D rH нач. и D rH кон. представляют собой теплоты образования с обратным знаком;
б) продуктами сгорания, то величины D rH нач. и D rH кон. представляют собой энтальпии сгорания;
в) атомами, то величины D rH нач. и D rH кон. представляют собой энергии связей;

Рис. 2.2. К расчету тепловых эффектов по закону Гесса.
г) растворенными молекулами или ионами в растворах, то величины
D rH нач. и D rH кон. представляют собой теплоты растворения.
Например, для реакции
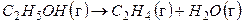 (2.60)
(2.60)
можно использовать следующую схему:

Рис. 2.3. К расчету теплового эффекта реакции (2.60).
Тогда

 ,
,
что и требовалось показать.
Стандартные теплоты сгорания и образования химических соединений приводятся в справочниках физико-химических величин (справочник: табл. 30, стр. 45; табл. 44, стр. 72-91). Заметим, что в дальнейшем изложении мы введем еще ряд функций состояния, для которых также справедлив закон Гесса.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 338; Нарушение авторских прав?; Мы поможем в написании вашей работы!