
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Следствия из закона Гесса
|
|
|
|
Стандартное состояние и стандартные условия.
Из закона Гесса вытекает ряд следствий, из которых два наиболее широко используются при расчете тепловых эффектов химических процессов. Но перед их рассмотрением следует разобрать вопрос о стандартизации термохимических вычислений.
Сопоставление тепловых эффектов и проведение термохимических расчетов привело к необходимости введения понятий стандартного теплового эффекта и стандартного состояния вещества, а также определения стандартных условий. Поскольку химические превращения весьма разнообразны, возникает проблема выбора начала отсчета энергетических величин. Рассчитывая различные величины, например, изменение энтальпии в реакции, далее можно находить параметры исследуемых процессов в заданных условиях.
Учитывая, что в химических реакциях элементы друг в друга не превращаются, в качестве нуля отсчета берут совокупность всех химических элементов в виде простых веществ, находящихся в наиболее устойчивых формах при 25 оС. Например, углерод берут в виде графита, бром – в виде жидкости. Исключения сделаны для фосфора и олова: для фосфора принимают за базисное вещество белый фосфор (соединение Р 4), а для олова – белое олово (b-олово), так как эти вещества более доступны. Эта выбранная совокупность простых веществ образует базис для проведения термохимических расчетов, а каждое простое вещество, входящее в базис, называется базисным.
Для выполнения термодинамических расчетов используют параметры вещества в стандартном состоянии. Стандартное состояние выбрано в соответствии с рекомендацией ИЮПАК следующим образом:
1) температура вещества в стандартном состоянии равна температуре системы: Т = Т (системы);
2) давление над веществом или давление газообразного вещества в стандартном состоянии равно 1 бар:
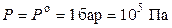 .
.
(Ранее в качестве стандартного состояния использовалась 1 атм = 101325 Па.)
3) Для газообразных веществ в качестве стандартного состояния выбирают гипотетическое состояние в виде идеальных газов.
4) Для жидких и твердых веществ в качестве стандартных состояний берут реальные состояния при давлении 1 бар и температуре Т.
Термодинамические величины, характеризующие вещества в стандартном состоянии, называются стандартными, а для их обозначения используют верхний индекс «градус», например
 .
.
Под стандартным тепловым эффектом реакции понимают величину, когда все участники реакции находятся в стандартных состояниях.
Для проведения термодинамических расчетов необходимо располагать информацией о термодинамических параметрах каждого вещества при любой температуре. Чтобы пользоваться такой информацией, целесообразно задаться некоторым значением температуры T 0, которое следует принять за начало отсчета.
В качестве T 0 (начала отсчета) используют температуру, равную 298,15 К (25 оС). Для сокращения записи вместо значения 298,15 К часто пишут просто 298 К или T 0.
Вещества в стандартном состоянии при температуре T0 находятся в стандартных условиях.
Теперь рассмотрим важнейшие для термохимических расчетов следствия из закона Гесса.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!