
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Краткая теория. Определение постоянной Ридберга и массы электрона
Аппаратура
ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА И МАССЫ ЭЛЕКТРОНА
3.1. Цель и содержание работы: ознокомление со спектром и системой энергетических состояний атома водорода. Изучение сериальной закономерности в спектре водорода, экспериментальное измерение длин волн серии Бальмера, определение спектроскопическим методом постоянной Ридберга и массы электрона; определение энергии ионизации, уровней энергии и размеров атома водорода в различных квантовых состояниях.
Монохроматор УМ-2, ртутная лампа, газоразрядная трубка с водородом, катушка Румкорфа, блок питания.
В результате исследований, проведенных во второй половине XIX в., было установлено, что пары каждого химического элемента при соответствующем возбуждении излучают вполне определенный спектр, состоящий из совокупности отдельных линий - так называемый линейчатый спектр. Причем атомам каждого химического элемента соответствует свой вполне определенный линейчатый спектр.
Таким образом, были заложены основы спектрального анализа - физического метода определения качественного и количественного состава вещества путем изучения его спектров (Кирхгоф, Бунзен, 1859). Анализ линейчатых спектров элементов сразу же привел к заключению, что линии в спектрах расположены не произвольно, беспорядочно, а закономерно. Возникла задача установить и объяснить эти закономерности.
Изучая линейчатый спектр водорода, швейцарский учитель физики И.Бальмер установил (1885), что длины волн известных в то время девяти линий спектра могут быть вычислены по формуле
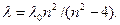 (3.1)
(3.1)
Формулу (3.1)обычно записывают в виде
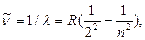 (3.2)
(3.2)
где R=10973731,77м-1, n=3,4,5.... 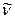 =1/λ -называется волновым числом. Константа R впервые была определена Ридбергом Р. и называется постоянной Ридберга. Формула Бальмера, впервые указавшая на особое значение целых чисел в спектральных закономерностях, сыграла выдающуюся роль в развитии учения о строении атомов. Если учесть большую точность спектроскопических измерений, то следует признать, что формула Бальмера принадлежит к числу наиболее точных закономерностей физики. Из формулы (3.2) видно, что все линии, отличающиеся различными значениями n, образуют группу, или серию, линий, называемую серией Бальмера. С увеличением n линии серии сближаются друг с другом. Значение n=
=1/λ -называется волновым числом. Константа R впервые была определена Ридбергом Р. и называется постоянной Ридберга. Формула Бальмера, впервые указавшая на особое значение целых чисел в спектральных закономерностях, сыграла выдающуюся роль в развитии учения о строении атомов. Если учесть большую точность спектроскопических измерений, то следует признать, что формула Бальмера принадлежит к числу наиболее точных закономерностей физики. Из формулы (3.2) видно, что все линии, отличающиеся различными значениями n, образуют группу, или серию, линий, называемую серией Бальмера. С увеличением n линии серии сближаются друг с другом. Значение n= определяет границу серии Бальмера. Ей соответствует длина волны λгр=3645,068
определяет границу серии Бальмера. Ей соответствует длина волны λгр=3645,068 10-10 м.
10-10 м.
Ридберг показал, что в линейчатых спектрах не только водорода, но и других элементов наблюдаются спектральные серии, причем волновые числа 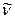 всех линий данной серии удовлетворяют соотношению
всех линий данной серии удовлетворяют соотношению
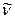 =T(n2)-T(n1), (3.3)
=T(n2)-T(n1), (3.3)
где n1 и n2 -некоторые целые числа. Функции Т(n2) и Т(n1) называются спектральными термами. Для данной серии n2 имеет постоянное значение. Изменение числа n1 дает все линии данной серии.
Тщательные исследования спектра водорода показали, что в нем наблюдаются пять серий спектральных линий. В ультрафиолетовой области спектра была обнаружена серия Лаймана
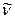 =1/λ=R
=1/λ=R , (3.3)
, (3.3)
где n=2,3,4...
В инфракрасной области были обнаружены:
серия Пашена 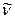 =R
=R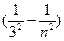 , где n=4,5,6...
, где n=4,5,6...
серия Брэкета 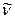 =R
=R , где n=5,6,7...
, где n=5,6,7...
серия Пфунда 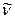 =R
=R , где n=6,7,8...
, где n=6,7,8...
серия Хэмфри 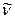 =R
=R , где n=7,8,9...
, где n=7,8,9...
Таким образом, все сериальные формулы спектра водорода могут быть выражены единой формулой
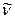 =1/λ=R
=1/λ=R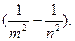 (3.4)
(3.4)
Линейчатый спектр атома водорода и закономерности (3.4) находятся в прямом противоречии с классическим истолкованием модели атома Резерфорда.
Применение классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами. Согласно классической теории, должны иметь место:
а) непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивость атома;
б) существование только непрерывного спектра. Спектральных линий существовать не должно.
В действительности оказывается, что а) атом является устойчивой системой; б)атом излучает энергию лишь при определенных условиях; в) излучение атома имеет линейчатый спектр.
Выход из создавшегося противоречивого положения был предложен Бором (1913). В основе теории Бора лежала идея связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света (гипотеза Планка), подтвержденные обширным экспериментальным материалом. Бор сформулировал законы, описывающие состояние и движение электронов в атоме в виде определенных постулатов. Постулаты эти таковы:
1. Электрон в атоме может вращаться только по строго определенным стационарным орбитам, радиусы которых определяются из условия
 , (3.5)
, (3.5)
где L – момент импульса электрона; n – главное квантовое число, принимающее положительное значение 1,2... и определяющее принадлежность электрона к той или иной орбите; h -постоянная Планка. Все другие орбиты «запрещены». Таким образом, Бор постулировал, что энергия электрона в атоме может принимать строго определенные дискретные значения Е1,Е2,....Еn... Вращаясь по стационарным орбитам, электрон не излучает и не поглощает электромагнитных волн.
2. Излучение происходит лишь при переходе электрона из стационарного состояния с большим значением энергии Еk в другое стационарное состояние с меньшим значением энергии Еi. При этом излучается квант энергии (фотон) строго определенной частоты. Излучение атома монохроматично, и частота его определяется фундаментальным соотношением (условие частот Бора)
Ek–Ei =hνik, (3.6)
где hνik -энергия излученного фотона.
Из соотношения (3.6) следует, что излучение происходит при переходе электрона с внешних орбит на внутренние. Если же электрон переходит с внутренних орбит на внешние, то энергия поглощается.
Сопоставление формулы (3.6) и (3.4) позволяет заключить, что энергия атома в некотором сстационарном состоянии
En=-Rhc/n2=-2πћRc/n2 где n=1,2,...., (3.7)
а спектральный терм связан с энергией атома формулой
T(n)=-En/hc=R/n2 (3.8)
Таким образом, целые числа, входящие в сериальные формулы (3.4) определяют квантовые значения энергии атома (энергетические уровни атома). Из формулы (3.7) следует, что энергетические состояния атома водорода образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Энергетическое состояние, соответствующее значению n=1, называется основным или нормальным (невозбужденным) состоянием. Все состояния с n>1 называются возбужденными. При n→ ,
,  →0. Знак минус в формуле (3.7) показывает, что электрон связан в атоме силой притяжения к ядру. Поэтому абсолютное значение En в формуле (3.7) считают энергией связи электрона в атоме, находящегося в состоянии n.
→0. Знак минус в формуле (3.7) показывает, что электрон связан в атоме силой притяжения к ядру. Поэтому абсолютное значение En в формуле (3.7) считают энергией связи электрона в атоме, находящегося в состоянии n.
 На рис. 3.1. приведена схема энергетических уровней атома водорода. Стрелками указаны переходы, соответствующие излучению различных серий спектральных линий.
На рис. 3.1. приведена схема энергетических уровней атома водорода. Стрелками указаны переходы, соответствующие излучению различных серий спектральных линий.
Постулаты позволили Бору рассчитать спектр атома водорода и водородоподобных ионов, а также теоретически вычислить соответствующие им значения постоянной Ридберга, находящиеся в хорошем согласии с опытом. Бор считал, что движение электрона в водородоподобной системе происходит по круговой орбите радиуса r под действием кулоновской силы притяжения электрона к ядру, обусловливающей центростремительное ускорение, т.е. можем записать:
 (3.9)
(3.9)
Из формулы (3.9), (3.5) получим
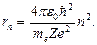 (3.10)
(3.10)
Энергия электрона в водородоподобной системе равна сумме кинетической энергии Еk и потенциальной Eп энергии в электростатическом поде ядра
E=Ek+Eп=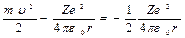 (3.11)
(3.11)
Подставив r в (З.ІІ) из (3.10) получим
 (3.12)
(3.12)
Сравнивая формулы (3.7) и (3.12), получим
 (3.13)
(3.13)
Теоретическое значение  немного отличается от экспериментального значения R. Расхождение объясняется тем, что при выводе формулы (3.13) ядро атома считалось неподвижным (ему приписывалась бесконечно большая масса). В действительности же ядро имеет конечную массу, вследствие чего происходят движения как электрона, так и ядра вокруг центра масс атома, поэтому вместо массы m электрона в в формулу (3.13) следует ввести приведенную массу: µ=mM/(m+M), где M масса ядра. Тогда
немного отличается от экспериментального значения R. Расхождение объясняется тем, что при выводе формулы (3.13) ядро атома считалось неподвижным (ему приписывалась бесконечно большая масса). В действительности же ядро имеет конечную массу, вследствие чего происходят движения как электрона, так и ядра вокруг центра масс атома, поэтому вместо массы m электрона в в формулу (3.13) следует ввести приведенную массу: µ=mM/(m+M), где M масса ядра. Тогда
 (3.14)
(3.14)
Следовательно, постоянная Ридберга должна зависеть от массы ядра:
 (3.14а)
(3.14а)
Приведенная масса µ будет иметь различные значения для разных изотопов, что приводит к некоторому различию уровней энергии и длин волн спектральных линий. Это явления называется изотопическим сдвигом. Именно по изотопическому сдвигу и был открыт тяжелый изотоп водорода – дейтерий (1932г.). Полученное, таким образом значение R для водорода находится в хорошем согласии с данными, полученными из спектроскопических измерений.
|
|
Дата добавления: 2014-01-04; Просмотров: 1441; Нарушение авторских прав?; Мы поможем в написании вашей работы!