
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение
|
|
|
|
ИЗУЧЕНИЕ СЕРИАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ В СПЕКТРАХ АТОМОВ ЩЕЛОЧНЫХ ЭЛЕМЕНТОВ.
4.1. Цель и содержание работы.
Освоение общих принципов систематики спектров сложных атомов. Измерения длин волн наиболее ярких линий в спектре излучения атома в Li, Na, K. Нахождение уровней энергии, энергии ионизации, значений квантового дефекта и эффективного заряда атома щелочных элементов.
4.2. Аппаратура: спектрограф ИСП-28 (ИСП-30), дуговой генератор ИВС-28, спектропроектор ДСП-1.
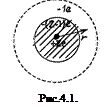 4.3.1. Строение атомов щелочных металлов. Из всех сложных атомов атомы щелочных элементов лития, натрия, калия, рубидия, цезия имеют наиболее простую внешнюю оболочку, состоящую только из одного электрона (рис.4.1.). Остальные Z-1 электронов атома образуют с ядром достаточно прочный атомный остов, такой же по структуре, как и предшествующий каждому из них в периодической системе атом благородного газа: гелия, неона, аргона, криптона, ксенона соответственно. Это делает похожим атом щелочного металла на атом водорода, причем атомный остов выполняет роль эффективного ядра с зарядом
4.3.1. Строение атомов щелочных металлов. Из всех сложных атомов атомы щелочных элементов лития, натрия, калия, рубидия, цезия имеют наиболее простую внешнюю оболочку, состоящую только из одного электрона (рис.4.1.). Остальные Z-1 электронов атома образуют с ядром достаточно прочный атомный остов, такой же по структуре, как и предшествующий каждому из них в периодической системе атом благородного газа: гелия, неона, аргона, криптона, ксенона соответственно. Это делает похожим атом щелочного металла на атом водорода, причем атомный остов выполняет роль эффективного ядра с зарядом  , близким по величине к единице. Отличия от атома водорода связаны с тем, что внешний электрон может частично проникать внутрь атомного остова. В силу общих квантовых законов электрон в атоме не имеет строгой локализации.
, близким по величине к единице. Отличия от атома водорода связаны с тем, что внешний электрон может частично проникать внутрь атомного остова. В силу общих квантовых законов электрон в атоме не имеет строгой локализации.
 , с которым взаимодействует электрон.
, с которым взаимодействует электрон.
Весьма существенным является то обстоятельство, что эффективное поле, в котором движется внешний электрон, обладает центральной симметрией. Вследствие этого потенциальная энергия электрона U зависит только от расстояния до центра r: U=U(r).На больших расстояниях электроны остова экранируют поле ядра, вследствие чего эффективное поле совпадает с кулоновским полем точечного заряда +1e, и потенциал U(r) оказывается таким же, как и в атоме водорода:
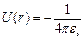

 .
.
Вблизи ядра, когда  экранировка не имеет места, и электрон взаимодействует непосредственно с ядром, имеющим заряд
экранировка не имеет места, и электрон взаимодействует непосредственно с ядром, имеющим заряд  При этом потенциальная энергия взаимодействия будет равна:
При этом потенциальная энергия взаимодействия будет равна:
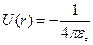

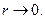
Для всей области изменения  можно записать
можно записать
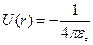
 (4.1)
(4.1)
где 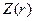 представляет собой некоторую функцию, плавно убывающую по мере увеличения
представляет собой некоторую функцию, плавно убывающую по мере увеличения  от величины
от величины 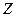 до 1. Очевидно, на всем протяжении кривая
до 1. Очевидно, на всем протяжении кривая 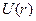 лежит ниже кривой для водородного потенциала:
лежит ниже кривой для водородного потенциала:


Ввиду сходства в строении атомов щелочных металлов и атома водорода у них оказываются аналогичными как расположение уровней энергии, так и спектры. Значит, прежде чем перейти к более детальному рассмотрению свойств щелочных атомов, целесообразно остановиться на квантовом описании атома водорода.
4.3.2. Квантовое описание атома водорода. Решения квантомеханического уравнения Шредингера для атома водорода:
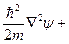
 (*)
(*)
приводить к следующим результатам. Прежде всего, получается, что связанные состояния атома водорода образуют дискретный набор с определенными значениями энергии  :
:
 или
или  , n=1,2,3,…., (4.2)
, n=1,2,3,…., (4.2)
где  =13,6 эВ-энергия ионизации атома водорода из основного состояния;
=13,6 эВ-энергия ионизации атома водорода из основного состояния;  - постоянная Ридберга; n-главное квантовое число, которое может принимать все целые значения, начиная с единицы. Уровни энергии
- постоянная Ридберга; n-главное квантовое число, которое может принимать все целые значения, начиная с единицы. Уровни энергии  являются вырожденными, т.е. каждому уровню (а, следовательно, и каждому числу
являются вырожденными, т.е. каждому уровню (а, следовательно, и каждому числу  ) отвечает несколько состояний, которое различаются формой электронного облака и величиной орбитального момента импульса электрона
) отвечает несколько состояний, которое различаются формой электронного облака и величиной орбитального момента импульса электрона .
.
Орбитальный момент квантуется по закону
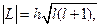
где 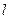 - орбитальное квантовое число:
- орбитальное квантовое число:
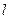 =0,1,2,3,….,
=0,1,2,3,…., -1. (4.3)
-1. (4.3)
Состояния с различными значениями 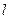 принято обозначать латинскими буквами:
принято обозначать латинскими буквами:
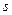
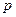
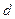
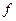
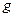


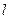 = 0 1 2 3 4 5 6
= 0 1 2 3 4 5 6
и соответственно называть 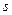 - состояниями,
- состояниями, 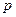 - состояниями,
- состояниями, 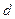 - состояниями и т.д.
- состояниями и т.д.
 Общее представление о форме электронных облаков в состояниях с разными
Общее представление о форме электронных облаков в состояниях с разными 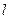 дает рис.4.2. На нем изображены, для двух состояний графики величины
дает рис.4.2. На нем изображены, для двух состояний графики величины  характеризующей плотность вероятности обнаружить электрон в шаровом слое между радиусами
характеризующей плотность вероятности обнаружить электрон в шаровом слое между радиусами  и
и  . Общая закономерность такова: электронные облака увеличиваются в размерах прямо пропорционально квадрату главного квантового числа
. Общая закономерность такова: электронные облака увеличиваются в размерах прямо пропорционально квадрату главного квантового числа  и перераспределяются к периферии с увеличением орбитального квантового числа
и перераспределяются к периферии с увеличением орбитального квантового числа  .
.
Следует подчеркнуть, что вырождение энергии по  в атоме водорода является случайным и связано с тем, что потенциал спадает как функция
в атоме водорода является случайным и связано с тем, что потенциал спадает как функция .
.
4.3.3. Уровни энергии атомов щелочных элементов. Энергии стационарных состояний атома щелочного элемента можно найти с помощью уравнения Шредингера (*). Однако здесь потенциальная энергия будет не как у атома водорода, а другой. Если атом щелочного элемента имеет всего 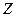 электронов, то можно считать, что
электронов, то можно считать, что  электронов вместе ядром образует сравнительно прочный остов, в электрическом поле которого движется внешний (валентный) электрон, довольно слабо связанный с остовом атома. В некотором смысле атома щелочных элементов являются водородными, однако, не полностью. Дело в том, что внешний электрон несколько деформирует электронный остов и тем самым искажает поле, в котором движется. В первом приближении поле остова можно рассматривать как суперпозицию поле точечного заряда +е, и поле точечного диполя, расположенных в центре остова. При этом ось диполя направлена все время к внешнему электрону. Поэтому движение последнего происходит так, как если бы поле остова, несмотря на искажение, сохранялось сферически – симметричным. Это позволяет представить потенциальную энергию внешнего электрона в поле такого остова как:
электронов вместе ядром образует сравнительно прочный остов, в электрическом поле которого движется внешний (валентный) электрон, довольно слабо связанный с остовом атома. В некотором смысле атома щелочных элементов являются водородными, однако, не полностью. Дело в том, что внешний электрон несколько деформирует электронный остов и тем самым искажает поле, в котором движется. В первом приближении поле остова можно рассматривать как суперпозицию поле точечного заряда +е, и поле точечного диполя, расположенных в центре остова. При этом ось диполя направлена все время к внешнему электрону. Поэтому движение последнего происходит так, как если бы поле остова, несмотря на искажение, сохранялось сферически – симметричным. Это позволяет представить потенциальную энергию внешнего электрона в поле такого остова как:
 (4.4)
(4.4)
где 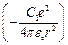 поправка, учитывающая отличие поля атомов щелочного элемента от поля атома водорода. Электрическое поле атомного остова сферически – симметричное, т.е. можно считать не зависящим с углом
поправка, учитывающая отличие поля атомов щелочного элемента от поля атома водорода. Электрическое поле атомного остова сферически – симметричное, т.е. можно считать не зависящим с углом  и
и 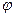 . Тогда угловая часть уравнения Шредингера будет такой же, как в случае водородоподобного атома.
. Тогда угловая часть уравнения Шредингера будет такой же, как в случае водородоподобного атома.
Уравнение Шредингера для  радиальной волновой функции измениться тем, что в нем вместо энергии
радиальной волновой функции измениться тем, что в нем вместо энергии  надо подставить выражение (4.4).
надо подставить выражение (4.4).
Для атома водорода уравнение Шредингера для  имеет следующий вид
имеет следующий вид
 . (4.5)
. (4.5)
Если записать это уравнение для атома щелочного элемента, то в уравнении (4.5) вместо двух последних выражений в скобках надо подставить выражение:
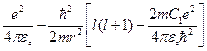 . (4.6.а)
. (4.6.а)
Если ввести обозначение:
 , (4.6.б)
, (4.6.б)
то вместо (4.5) получаем уравнение аналогичного вида:
 . (4.7)
. (4.7)
Для атома водорода решение уравнения (4.5) известно. Теперь решение уравнения (4.7), будет таким же как у атома водорода, только здесь 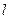 заменяется на
заменяется на  . Таким образом для энергии атома щелочного элемента получается выражение как у атома водорода, только квантовое число
. Таким образом для энергии атома щелочного элемента получается выражение как у атома водорода, только квантовое число 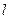 заменится на
заменится на  :
:
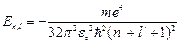 . (4.8)
. (4.8)
Квантовое число  , согласно (4.6.б), не является целым числом:
, согласно (4.6.б), не является целым числом:
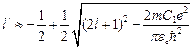 . (4.9)
. (4.9)
Здесь в подкоренном выражении первый намного превосходит второй. Поэтому можно приближенно написать:
 . (4.9а)
. (4.9а)
Таким образом, из (4.8) следует, что уровни энергии атомов щелочных элементов определяется формулой:
 (4.8)
(4.8)
где 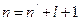 - главное квантовое число. Величину
- главное квантовое число. Величину 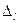 называют квантовым дефектом. В отличие от формулы (4.2) для водородоподобного атома уровни энергии атомов щелочных элементов зависит не только главного квантового числа, но и орбитального квантового числа. Это означает, что при одном и том же значении числа
называют квантовым дефектом. В отличие от формулы (4.2) для водородоподобного атома уровни энергии атомов щелочных элементов зависит не только главного квантового числа, но и орбитального квантового числа. Это означает, что при одном и том же значении числа  уровни энергии различны для разных значений числа
уровни энергии различны для разных значений числа 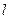 . В этом случае говорят, что происходит устранение вырождения по орбитальному квантового числу. С при больших
. В этом случае говорят, что происходит устранение вырождения по орбитальному квантового числу. С при больших 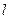 поправки
поправки 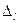 ослабевает (см. таблица 4.1).Поэтому зависимость энергии щелочного атома от числа
ослабевает (см. таблица 4.1).Поэтому зависимость энергии щелочного атома от числа 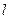 при больших его значениях практически незаметно.
при больших его значениях практически незаметно.
Спектральные термы для атомов щелочного элементов определяются формулой:
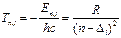
Таблица 4.1
| Элемент | 
| 
| 
| 
|
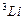



| 0.412 1.373 2.230 3.195 | 0.041 0.883 1.776 2.711 | 0.002 0.010 0.146 1.233 | 0.000 0.001 0.007 0.012 |
На рис 4.3 приведена схема уровней атомов щелочных металлов  (уровни изображены в виде точек). Для сравнения там же пунктиром нанесены уровни энергии атома водорода. У атомов щелочных металлов уровни с разными
(уровни изображены в виде точек). Для сравнения там же пунктиром нанесены уровни энергии атома водорода. У атомов щелочных металлов уровни с разными 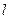 , но одинаковыми
, но одинаковыми расположены сравнительно далеко друг от друга (у атома
расположены сравнительно далеко друг от друга (у атома  уровни вырождены по
уровни вырождены по 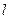 ).
).
По мере увеличения энергии возбуждения наблюдается сближение уровней атомов щелочных металлов с соответствующими им уровнями атома  . Поэтому, начиная с определенной энергии можно говорить о «водородо подобности» состояний атомов щелочных металлов. Например, водородоподобными являются состояния 3d, 4d,…. у атома
. Поэтому, начиная с определенной энергии можно говорить о «водородо подобности» состояний атомов щелочных металлов. Например, водородоподобными являются состояния 3d, 4d,…. у атома  или f – состояния атомов всех щелочных металлов.
или f – состояния атомов всех щелочных металлов.
4.3.4. Спектры щелочных элементов. Спектры испускания атомов щелочных металлов, как и спектр атома водорода, состоят из множества линий. Кропотливая систематика этих линий позволила группировать их в серии, каждая из которых связаны с переходом возбужденного атома на какой – то определенный уровень. Для атомов Li, это показано на рис.4.4, а для атомов Na, K- на рис. 1 и 2 приложения
 Исследования спектров ионов щелочного металлов показало, что момент импульса атомного остова равен нулю. Следовательно, орбитальный момент атома щелочного металла оказывается равным моменту его внешнего электрона и определяется квантовым числом
Исследования спектров ионов щелочного металлов показало, что момент импульса атомного остова равен нулю. Следовательно, орбитальный момент атома щелочного металла оказывается равным моменту его внешнего электрона и определяется квантовым числом 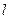 (что и показано на рис.4.4). Орбитальные и спиновые моменты всех внутренних электронов взаимно компенсируются, вследствие чего спиновой, орбитальный и полный моменты атама, а также его квантовые числа совпадают с соответствующими моментами и квантовыми числами внешнего электрона (табл.4.2).
(что и показано на рис.4.4). Орбитальные и спиновые моменты всех внутренних электронов взаимно компенсируются, вследствие чего спиновой, орбитальный и полный моменты атама, а также его квантовые числа совпадают с соответствующими моментами и квантовыми числами внешнего электрона (табл.4.2).
Таблица 4.2
| элемент | Li | Na | K | Rb | Cs |
| Z n Основное состояние |
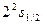
|
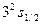
|

|

|

|
Правила отбора. Излучение (и поглощение) происходит в результате перехода внешнего электрона с одного уровня на другой. Однако не все переходы возможны. Возможны лишь те, при которых орбитальное квантовой число 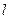 внешнего электрона меняется на единицу:
внешнего электрона меняется на единицу:
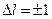 (4.10)
(4.10)
При этом главное квантовое число  может изменяться на любое целое число. Это означает, что разрешенными являются переходы лишь между s- и p-состояниями, между p- и d- состояниями и т.д (рис. 4.4).
может изменяться на любое целое число. Это означает, что разрешенными являются переходы лишь между s- и p-состояниями, между p- и d- состояниями и т.д (рис. 4.4).
Спектральные серии. С учетом правила отбора (4.10) в спектрах атомов лития наблюдается следующие серии:
Главная: 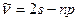
 =2,3,4,…
=2,3,4,…
Резкая: 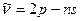
 =3,4,5,… (4.11)
=3,4,5,… (4.11)
Диффузная: 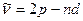
 =3,4,5…
=3,4,5…
Серии (4.11) записаны в символической форме. В явном виде их записывают как разности двух соответствующих термов. Например, для главной серии Li:
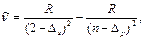
 =2,3,4,… (4.12)
=2,3,4,… (4.12)
Аналогично и для других серий. Заметим, что 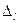 квантовые дефекты в пределах каждый серии практически постоянные, но меняются от серии к серии. Спектральная линия главной серии, соответствующая переходу 2s-2p, является самой интенсивной. Эту линию называет резонансной.
квантовые дефекты в пределах каждый серии практически постоянные, но меняются от серии к серии. Спектральная линия главной серии, соответствующая переходу 2s-2p, является самой интенсивной. Эту линию называет резонансной.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 216; Нарушение авторских прав?; Мы поможем в написании вашей работы!