
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретическое введение
|
|
|
|
ИЗУЧЕНИЕ СТРУКТУРЫ СПЕКТРА АТОМОВ С ДВУМЯ ВАЛЕНТНЫМИ ЭЛЕКТРОНАМИ
6.1. Цель работы: Исследование спектров излучения паров цинка,кадмия и ртути в видимой области, изучение структуры спектров этих элементов, экспериментальное определение триплетного расщепления.
6.2. Аппаратура: монохроматор УМ-2, ртутная лампа, ВСБ-2 лампы с парами ртути, кадмия и цинка, блок питания ППБЛ-2.
Для задания состояния электрона в атоме необходимы четыре квантовых числа: 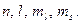
Главное квантовое число n, которое в основном определяет энергию электрона и принимает значения n=1,2,… 
Орбитальное квантовое число  , определяющее значение орбитального момента импульса электрона в соответствии с равенством
, определяющее значение орбитального момента импульса электрона в соответствии с равенством 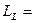
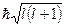 ; число
; число 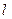 может принимать значения
может принимать значения 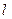 =0,1,…,(n-1)–всего n значений.
=0,1,…,(n-1)–всего n значений.
Магнитное квантовое число m определяющее проекцию момента импульса электрона на направление квантования z (например, направление внешнего магнитного поля); 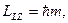 ,
,  при этом m=0,
при этом m=0,  1,
1,  2,…,
2,…,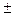
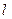 – всего
– всего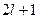 значений.
значений.
Спиновое квантовое число s, которое определяет собственный (спиновый) момент импульса микрочастицы. 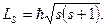 Для электрона s=1/2, поэтому проекция его спинового момента импульса на направление квантования (ось z) может принимать лишь два значения:
Для электрона s=1/2, поэтому проекция его спинового момента импульса на направление квантования (ось z) может принимать лишь два значения: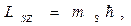
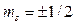 .
.
В соответствии со значением числа  состояния электрона в атоме обозначают следующим образом: если
состояния электрона в атоме обозначают следующим образом: если 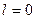 ,состояние называют s-состоянием (или s-электроном), если
,состояние называют s-состоянием (или s-электроном), если 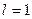 -это p-состояние, если
-это p-состояние, если 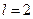 -это d-состояние, и.т.д. Символ 2p обозначает, что n=2 и
-это d-состояние, и.т.д. Символ 2p обозначает, что n=2 и 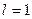 ,символ 3s отвечает n=3 и
,символ 3s отвечает n=3 и 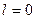 ,символ 3d соответствует n=3,
,символ 3d соответствует n=3, 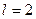 .
.
Согласно принципу Паули в системе электронов (например, в атоме) не может быть двух электронов с одинаковым набором четырех квантовых чисел. Этот принцип вместе с принципом наименьшей энергии устанавливает распределение электронов по квантовым состояниям (оболочкам), а также связывает это распределение с периодичностью свойств атома.
Химические и оптические свойства электронных систем определяются числом его валентных электронов, поэтому спектры систем с одним и тем же числом валентных электронов имеют много общего.
Чем больше валентных электронов в атоме и чем больше порядковый номер элемента, тем более сложна структура спектра.
1. В атоме водорода имеется лишь один электрон, находящийся в кулоновском поле ядра. Как показано в квантовой механике, стационарные значения энергии его уровней зависят лишь от значения главного квантового числа n.
2. Атомы щелочных металлов (Li,Na,K, Rb,Cs) представляют систему, состоящую из ядра, электронов внутренних оболочек и одного внешнего (валентного) электрона. Остальные Z-1 электронов вместе с ядром образуют устойчивый «остов» (атомный «остаток»). Такую электронную систему рассматривают как «водородоподобную», где в поле атомного «остатка» движется слабо связанный электрон. Определение энергетических уровней водородоподобных систем с учетом возмущения вызванного атомным остатком, показывает, что значения энергии зависят не только от главного квантового числа n, но и от орбитального квантового числа  валентного электрона, так что
валентного электрона, так что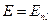 .
.
Стационарные значения энергии, соответствующие состояниям электрона с одинаковым квантовым числом n, но различными значениями орбитального квантового числа  , оказываются разными (см., например, схему энергетических уровней валентного электрона Na на рис.4.6.).
, оказываются разными (см., например, схему энергетических уровней валентного электрона Na на рис.4.6.).
Испускание и поглощение электромагнитных волн происходит при переходах электрона с одного уровня на другой. В квантовой механике показано, что возможны только такие переходы, при которых число  изменяется на единицу:
изменяется на единицу: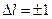 . На рис.4.6. показаны переходы в спектре атомов натрия, разрешенные этим правилом (наклонные линии).
. На рис.4.6. показаны переходы в спектре атомов натрия, разрешенные этим правилом (наклонные линии).
Валентный электрон атома натрия кроме орбитального момента импульса 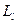 имеет собственный спиновый момент
имеет собственный спиновый момент 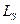 , и полный момент импульса электрона
, и полный момент импульса электрона 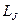 является суммой этих моментов. Сложение моментов осуществляется по квантовым законам; величина
является суммой этих моментов. Сложение моментов осуществляется по квантовым законам; величина 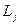 может принимать лишь дискретные значения:
может принимать лишь дискретные значения:
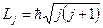 .
.
где j-новое квантовое число, принимающее значение  +s,
+s, 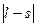 . При
. При 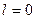 число j имеет только одно значение j=1/2. При
число j имеет только одно значение j=1/2. При  , отличном от нуля, j имеет два значения:
, отличном от нуля, j имеет два значения: 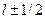 .
.
Известно, что с механическими моментами импульсов электронов связаны магнитные дипольные моменты, которые взаимодействуют друг с другом подобно двум контурам с током. Энергия этого взаимодействия зависит от «взаимной ориентации» орбитального и спинового магнитных моментов. Следовательно, состояние с разными значениями числа j должны иметь различную энергию. Квантово-механическое решение задачи нахождения стационарных значений энергии с учетом такого спин-орбитального взаимодействия действительно показывает, что значения энергии зависят уже от трех квантовых чисел n,  , j, так что
, j, так что 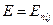 . Этот теоретический результат хорошо подтверждается экспериментально. Например каждый энергетический уровень (
. Этот теоретический результат хорошо подтверждается экспериментально. Например каждый энергетический уровень (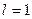 )расщепляется на два подуровня, соответствующих значениям числа j=1/2и j=3/2,d-уровень (
)расщепляется на два подуровня, соответствующих значениям числа j=1/2и j=3/2,d-уровень (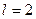 )-на уровни с j=3/2 и j=5/2.Каждому s-уровню (
)-на уровни с j=3/2 и j=5/2.Каждому s-уровню (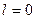 )соответствует только одно значение j=1/2,поэтому уровень s не расщепляется.
)соответствует только одно значение j=1/2,поэтому уровень s не расщепляется.
Таким образом, все уровни атома натрия,за исключением s уровня, распадаются на два подуровня, так называемые дублеты 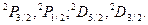 Нижний индекс справа относится к значению числа j,верхний слева указывает мультиплетность уровня (рис.4.6.). Обозначение уровней (состояний) электрона пояснены ниже.
Нижний индекс справа относится к значению числа j,верхний слева указывает мультиплетность уровня (рис.4.6.). Обозначение уровней (состояний) электрона пояснены ниже.
3. Для многоэлектронных атомов полный орбитальный и спиновый моменты импульса складываются из моментов импульсов отдельных электронов. При этом для замкнутых (заполненных электронами) оболочек суммарный момент импульса равен нулю. Атом в целом характеризуется суммарными моментами импульса электронов только незаполненных (например, валентных) оболочек.
Орбитальные и спиновые моменты импульса валентных электронов складывается с соблюдением квантово-механических законов пространственного квантования (взаимного расположения векторов), образуя суммарный вектор  полного момента импульса. Результат такого сложения зависит от порядка суммирования. Обычно рассматривают две модельные ситуации:
полного момента импульса. Результат такого сложения зависит от порядка суммирования. Обычно рассматривают две модельные ситуации:
1) сначала суммируют по отдельности орбитальные и спиновые моменты валентных электронов, а затем определяют суммарный момент импульса;
2) сначала суммируют орбитальный и собственный моменты импульса каждого валентного электрона, а затем находят сумму по всем электронам.
Анализ экспериментальных спектров позволяет уяснить, какой из порядков суммирования реализуется и, следовательно, какая связь прочнее: связь спинов разных электронов или связь спинового и орбитального моментов каждого электрона. В большинстве случаев (для атомов с небольшим числом электронов) имеет место связь первого рода (так называемая LS-связь, рессель – саундеровская связь).
На рис.6.1. представлена векторная схема сложения орбитального и спинового моментов импульса атома с двумя валентными электронами при LS-связи. Числовые значения результирующих моментов импульса такого атома определяются выражениями
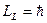
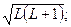
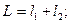
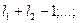
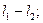
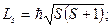
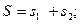
 (6.1)
(6.1)
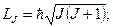


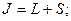
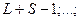
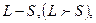
причем  и
и  - орбитальные, а
- орбитальные, а 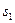 и
и 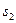 -спиновые квантовые числа валентных электронов. Для атома с двумя валентными электронами S может быть равно 0 и 1 и
-спиновые квантовые числа валентных электронов. Для атома с двумя валентными электронами S может быть равно 0 и 1 и 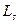 принимает два значения
принимает два значения и
и 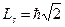 . Состояния атома с различными значениями числа
. Состояния атома с различными значениями числа 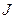 соответствует различным взаимным ориентациям орбитальных и спиновых моментов импульса. Такие состояния характеризуются поэтому различной энергией.
соответствует различным взаимным ориентациям орбитальных и спиновых моментов импульса. Такие состояния характеризуются поэтому различной энергией.
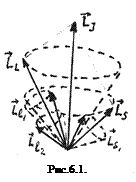 При заданных L и S число различных значений J, как показывает выражение (6.1), равно 2S+1. Это означает, что уровень энергии атома с данными L и S при L>S расщепляется на 2S +1 подуровней. Число подуровней называют мультиплетностью. В системе из двух электронов S=0 и S=1, следовательно, мультиплетность может быть равна 1 и 3, образуют уровни - одиночники (синглетные) и триплетные уровни. Мультиплетность уровней энергии приводит к своеобразным закономерностям во взаимном расположении линий в спектре излучения атомов. На практике именно анализ спектров позволил впервые получить сведения об относительном расположении энергетических уровней атомов и электронной структуре атомов, а также связать мультиплетную структуру энергетических уровней со своеобразным и существенным свойством электрона -спиновым моментом импульса.
При заданных L и S число различных значений J, как показывает выражение (6.1), равно 2S+1. Это означает, что уровень энергии атома с данными L и S при L>S расщепляется на 2S +1 подуровней. Число подуровней называют мультиплетностью. В системе из двух электронов S=0 и S=1, следовательно, мультиплетность может быть равна 1 и 3, образуют уровни - одиночники (синглетные) и триплетные уровни. Мультиплетность уровней энергии приводит к своеобразным закономерностям во взаимном расположении линий в спектре излучения атомов. На практике именно анализ спектров позволил впервые получить сведения об относительном расположении энергетических уровней атомов и электронной структуре атомов, а также связать мультиплетную структуру энергетических уровней со своеобразным и существенным свойством электрона -спиновым моментом импульса.
4. Для атомов с двумя валентными электронами, к которым принадлежит гелий, щелочноземельные элементы, а также цинк, кадмий и ртуть, структура термов усложняется. В отличие от одного дублетного терма щелочных элементов получаются две системы термов: система синглетных (одиночных) термов (S=0, J=L) и система триплетных термов (S=1, J=L+1, L, L-1).
Анализ спектров излучения и поглощения каждого элемента в УФ, видимой и ИК областях спектра позволяет составить полную схему возможных термов и переходов. Символ термов содержит указание о мультиплетности χ=2S+1 в показателе слева сверху символа терма, о квантовом числе J общего момента импульса – справа снизу терма. Например, символическая запись 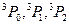 означает триплетный терм с орбитальным квантовым числом L=1, S=1, следовательно, мультиплетность χ=2S+1=3. При этом L и S комбинируются так, что J=0,1,2. Одиночные (синглетные) термы символически обозначаются через
означает триплетный терм с орбитальным квантовым числом L=1, S=1, следовательно, мультиплетность χ=2S+1=3. При этом L и S комбинируются так, что J=0,1,2. Одиночные (синглетные) термы символически обозначаются через 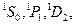 для которых χ=2S+1=1. Для каждой системы термов (синглетной и триплетной) при переходах между термами данной системы существуют правила отбора, определяемые формулами:
для которых χ=2S+1=1. Для каждой системы термов (синглетной и триплетной) при переходах между термами данной системы существуют правила отбора, определяемые формулами:
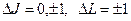 . (6.2)
. (6.2)
В результате синглетные термы комбинируются друг с другом (синглет-синглетные переходы), получаются серии, аналогичные сериям атомов щелочных элементов, состоящие из одиночных линий. Так же как и в спектрах щелочных элементов, эти серии часто называют главной, резкой, диффузной и фундаментальной. Триплетные термы также комбинируются между собой (триплет-триплетные переходы), возникают серии, аналогичные сериям щелочных элементов с теми же названиями. Линии, связанные с переходами между термами триплетной системы, представляют собой триплеты (главная и резкая серии) и секстеты (шесть линий) в диффузной и фундаментальной сериях.
В пределах каждой системы термов правилами отбора разрешены переходы следующих типов:
| Синглетные | Триплетные |
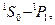 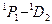
| 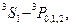 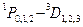
|
 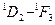
| 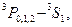 
|
 Кроме указанных переходов существует еще так называемые интеркомбинационнные переходы между синглетными и триплетными термами. Спектры атомов Zn, Cd, Hg очень схожи между собой. Основное состояние их
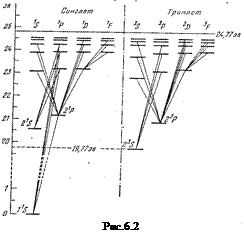
Кроме указанных переходов существует еще так называемые интеркомбинационнные переходы между синглетными и триплетными термами. Спектры атомов Zn, Cd, Hg очень схожи между собой. Основное состояние их 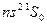 –самый глубокий терм. На рис.6.2. приведена диаграмма уровней и переходы для гелия He I, а на рис. 6.3.–соответственно для ртути Hg I.
–самый глубокий терм. На рис.6.2. приведена диаграмма уровней и переходы для гелия He I, а на рис. 6.3.–соответственно для ртути Hg I.
Диаграмма уровней энергии атома гелия и возможные переходы изображены на рис.6.2. Для атома He существуют те же спектральные серии, что и для атомов щелочных металлов, но только в двух экземплярах, соответствующих синглетам и триплетам: две главные серии, две резких, две диффузных и т.д.
Два электрона атома He заполняют К-слой (электронная конфигурация 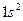 ). Это значит, что основные состояние атома He–
). Это значит, что основные состояние атома He– 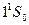 . Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Отметим, что состояние
. Все остальные состояния как в синглетах, так и в триплетах являются возбужденными. Отметим, что состояние 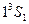 отсутствует. На опыте не наблюдается каких-либо линий, связанных с этим состоянием. В этом состоянии четверка квантовых чисел для обоих электронов совпадает:
отсутствует. На опыте не наблюдается каких-либо линий, связанных с этим состоянием. В этом состоянии четверка квантовых чисел для обоих электронов совпадает: 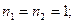
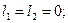
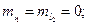
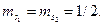 Т.о., отсутствие терма
Т.о., отсутствие терма 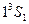 , является прямым следствием принципа запрета Паули.
, является прямым следствием принципа запрета Паули.
Атомы Zn, Cd, Hg, как и атом He, имеют заполненную внешнюю s-оболочку. Их основным состоянием является 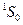 , и спектры аналогичны спектру атома He.
, и спектры аналогичны спектру атома He.
Зависимость от квантового числа J при данных L и S определяет триплетное расщепление. Причиной триплетного расщепления является, как и в случае дублетного, магнитное взаимодействие спиновых и орбитальных моментов. Энергия магнитного спин-орбитального взаимодействия при нормальной LS-связи выражается общей формулой
 (6.3)
(6.3)
где 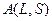 – фактор мультиплетного расщепления, зависящий от значений L и S и определяющий абсолютную величину мультиплетного расщепления. Расстояние между соседними уровнями, характеризуемыми квантовыми числами J и J+1,
– фактор мультиплетного расщепления, зависящий от значений L и S и определяющий абсолютную величину мультиплетного расщепления. Расстояние между соседними уровнями, характеризуемыми квантовыми числами J и J+1,
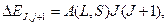 (6.4)
(6.4)
т.е.пропорционально большому квантовому числу J. Это соотношение называется правилом интервалов тонкого (мультиплетного) расщепления. Общая ширина мультиплетного терма, т.е. расстояние между уровнями c J=L+S и J=L-S, составит A(L,S)(2L+1)S при L≥S; A(L,S)(2S+1)L при L<S.
В спектрах атомов Zn, Cd и Hg надо обратить внимание на следующее обстоятельство: для больших атомных номеров мультиплетное расщепление из-за спина электрона (естественное расщепление терма) имеет большие значения. Например, триплетный терм ртути 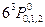 имеет расщепление порядка нескольких электрон-вольт и составляющие триплета
имеет расщепление порядка нескольких электрон-вольт и составляющие триплета 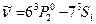 (546,073 нм),
(546,073 нм),  (435,833 нм),
(435,833 нм), 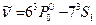 (404,656 нм) лежат в различных областях видимого спектра.
(404,656 нм) лежат в различных областях видимого спектра.
В работе исследуют спектр излучения паров цинка, ртути и кадмия. Атомы Zn, Cd и Hg в наружной электронной оболочке имеют два электрона. Результирующие моменты импульсов 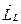 и
и 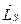 внутренних оболочек равны нулю.
внутренних оболочек равны нулю.
Рис.6.3. Схема энергетических уровней атома ртути.
На рис.6.3 изображены схема энергетических уровней атома ртути и возможные переходы между ними. В нормальном состоянии оба наружных электрона являются 6s-электронами, поскольку их главные квантовые числа n=6,а орбитальные  = 0. Далее предполагается, что один из электронов всегда остается в невозбужденном 6s – состоянии, а второй может возбуждаться с изменением квантовых чисел. Так как
= 0. Далее предполагается, что один из электронов всегда остается в невозбужденном 6s – состоянии, а второй может возбуждаться с изменением квантовых чисел. Так как 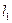 остается нулем, результирующее число L совпадает с
остается нулем, результирующее число L совпадает с 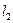 . Результирующий спиновый момент импульса, как отмечено выше, может соответствовать S=0 и S=1.
. Результирующий спиновый момент импульса, как отмечено выше, может соответствовать S=0 и S=1.
Энергетические уровни (состояния) электронов в многоэлектронных атомах, ответственные за спектральные линии, характеризует термами 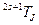 ,где
,где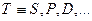 для числа
для числа 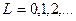 . Левый верхний индекс у символа терма определяет мультиплетность уровня, правый нижний -число
. Левый верхний индекс у символа терма определяет мультиплетность уровня, правый нижний -число 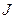 .В такой терминологии возможные состояния атома ртути представлены в табл.6.1.
.В такой терминологии возможные состояния атома ртути представлены в табл.6.1.
Таблица 6.1
| 1-й электрон | 2-й электрон | L | S=0 | S=1 | ||
| J | Символ терма | J | Символ терма | |||
| 6s | 6s | 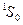
| 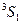
| |||
| 6s | 6p | 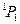
| 0,1,2 | 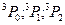
| ||
| 6s | 7s | 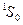
| 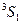
| |||
| 6s | 7p | 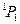
| 0,1,2 | 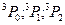
| ||
| 6s | 6d | 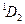
| 1,2,3 | 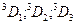
|
На рис.6.3 в вертикальном направлении отложена полная энергия системы электрон-одновалентный ион. За нулевое значение энергии этой системы принимают энергию, соответствующую полному отщеплению одного электрона от атома, поэтому энергия системы отрицательна. Числа 6,7,8…соответствуют значениям главного квантового числа валентного электрона. Оболочки с главными квантовыми числами n=1,2,3,4,5 занимают 78 внутренних электронов атома ртути. Эти электроны в образовании оптического спектра не участвуют. Уровень энергии, соответствующий нормальному состоянию атома ртути 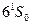 , лежит на глубине 10,43 эВ; это означает, что работа ионизации атома Hg составляет 10,43эВ.На рис.6.3. изображены также возможные переходы между уровнями(при переходах выполняются квантово-механические правила отбора
, лежит на глубине 10,43 эВ; это означает, что работа ионизации атома Hg составляет 10,43эВ.На рис.6.3. изображены также возможные переходы между уровнями(при переходах выполняются квантово-механические правила отбора 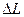 =
=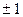 и
и 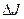 =
=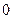 ;
;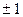 ). Наиболее типичные спектральные линии соответствует переходам:
). Наиболее типичные спектральные линии соответствует переходам:
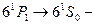 длина волны 253,7 нм (ультрафиолетовая область спектра);
длина волны 253,7 нм (ультрафиолетовая область спектра);
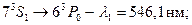
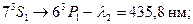
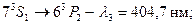
-триплет с соответственно длинами волн 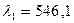 нм,
нм,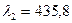 нм и
нм и 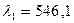
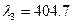 нм
нм
Спектры атомов цинка, кадмия и ртути сходны между собой.
Зависимость энергии от квантового числа J при данных L и S определяет значение триплетного расщепления: для больших атомных номеров расщепление имеет большее значение. Если определить длины волн спектральных линий, можно построить схему энергетических уровней атомов. В работе необходимо обнаружить и измерить длины волн спектральных линий триплета Zn.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 389; Нарушение авторских прав?; Мы поможем в написании вашей работы!