
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
II. Атом водорода по резерфорду-бору
|
|
|
|
§ 6. Модели строения атома.
Опыты Резерфорда по рассеянию 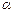 -частиц.
-частиц.
До конца ХIХ века считалось, что атомы – мельчайшие неделимые частицы вещества. Но открытие электрона показало, что эта отрицательно заряженная частица почти в 2000 раз легче атома и входит в состав любых атомов.
При различных процессах атомы теряют электроны и превращаются в положительно заряженные ионы. Это означает, что атомы – сложные образования и состоят из положительно заряженных частиц и электронов. Как распределены эти частицы в атоме – было не известно.
Первая попытка создания модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар с радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны. Суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. равномерно распределенным положительным зарядом и внутри сферы находятся электроны. Позднее было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
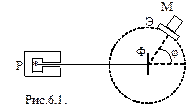 В 1910-1911 гг. Э. Резерфорд с сотрудниками (Г. Гейгер и Э. Марсденн) провел опыты по зондированию атомов с целью выяснения характера распределения положительных и отрицательных зарядов в атоме. Для этого узкий пучок a - частиц, испускаемых радиоактивным веществом Р, направлялся на тонкую металлическую фольгу Ф, за ней помещался экран Э, который был покрыт сернистым цинком и при соударение с a-частицами экран светился. Вызываемые ударами a-частиц вспышки света наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги.
В 1910-1911 гг. Э. Резерфорд с сотрудниками (Г. Гейгер и Э. Марсденн) провел опыты по зондированию атомов с целью выяснения характера распределения положительных и отрицательных зарядов в атоме. Для этого узкий пучок a - частиц, испускаемых радиоактивным веществом Р, направлялся на тонкую металлическую фольгу Ф, за ней помещался экран Э, который был покрыт сернистым цинком и при соударение с a-частицами экран светился. Вызываемые ударами a-частиц вспышки света наблюдались в микроскоп М. Микроскоп и экран можно было вращать вокруг оси, проходящей через центр рассеивающей фольги.
Напомним, a-частицы – это частицы, которые испускаются некоторыми радиоактивными элементами. Они обладают положительным зарядом, равным удвоенному элементарному заряду и движутся со скоростью  =107 м/с, поэтому обладают большой проникающей способностью.
=107 м/с, поэтому обладают большой проникающей способностью.
Опыты показали, что a-частицы, пролетая через фольгу, рассеивались на разные углы. В некоторых случаях угол рассеивания j превышал 900. Объяснить это можно было взаимодействием a - частиц с положительным зарядом атома. Причем этот заряд должен занимать малый объем и обладать большой массой. На основании этих опытов Резерфорд предложил ядерную модель строения атома. Согласно Резерфорду атом представляет собой систему зарядов, в центре которой расположено тяжелое положительное ядро с зарядом Ze, имеющей размеры, не превышающие 10-14 м, а вокруг ядра расположены Z электронов, распределенных по всему объему, занимаемому атомом. Почти вся масса атома сосредоточена в ядре.
Однако ядерная модель оказалась в противоречии с законами классической механики и электродинамики. Поскольку система неподвижных зарядов не может находиться в устойчивом состоянии, Э.Резерфорду пришлось отказаться от статической модели атома и предположить, что электроны движутся вокруг ядра, описывая искривленные траектории. Но в этом случае электрон будет двигаться с ускорением, в связи с чем, согласно классической электродинамике, он должен непрерывно излучать электромагнитные (световые) волны и иметь сплошной спектр излучения. Процесс излучения сопровождается потерей энергии, так что электрон должен, в конечном счете, упасть на ядро. Из опыта известно, что атомы – это устойчивые образования, а спектр их излучения линейчатый, а не сплошной.
§7. Постулаты Бора. Опыты Франка и Герца.
Для объяснения противоречий модели строения атома опытным фактам датский физик Нильс Бор в 1913 г. обобщил гипотезу Планка для любой атомной системы, положив тем самым начало развитию квантовой теории строения атома. В основе теории Бора лежат два постулата:
I. Атомы и атомные системы могут длительное время находиться в определенных состояниях, называемых стационарными, при этом атом не излучает и не поглощает энергию. Энергии стационарных состояний образуют дискретный ряд Е 1, Е 2, Е 3,…
II. Атомы излучают или поглощают энергию при переходе из одного стационарного состояния в другое, при этом квант излучаемой или поглощаемой энергии определяется соотношением: hv = E n– E m, где En, Em – энергии стационарных состояний, между которыми произошел переход.
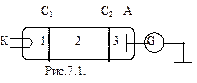 Данные постулаты экспериментально были подтверждены опытами немецких физиков Дж. Франка и Г. Герца. В трубке, заполненной парами ртути при малом давлении (давление приблизительно равно 13 Па) содержатся катод (К), две сетки (С1 и С2), анод (А). Исследовалась зависимость силы тока I от ускоряющего потенциала U между катодом и сеткой С1. Электроны, вылетающие из катода за счет термоэлектронной эмиссии, разгонялись в электрическом поле между катодом и сеткой С1, приобретая энергию
Данные постулаты экспериментально были подтверждены опытами немецких физиков Дж. Франка и Г. Герца. В трубке, заполненной парами ртути при малом давлении (давление приблизительно равно 13 Па) содержатся катод (К), две сетки (С1 и С2), анод (А). Исследовалась зависимость силы тока I от ускоряющего потенциала U между катодом и сеткой С1. Электроны, вылетающие из катода за счет термоэлектронной эмиссии, разгонялись в электрическом поле между катодом и сеткой С1, приобретая энергию 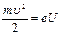 . Между сеткой С2 и анодом приложен небольшой (примерно 0,5 В) задерживающий потенциал. Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.
. Между сеткой С2 и анодом приложен небольшой (примерно 0,5 В) задерживающий потенциал. Электроны, ускоренные в области 1, попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода.
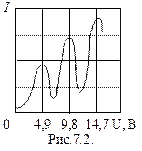 При увеличении ускоряющего потенциала от 0 до 4,9 В гальванометр показал монотонный рост анодного тока. При значениях U³4,9 В (и кратных ему значениях U³ 9,8 В; 14,7 В;…) на кривой I (U) появляются спады (рис.7.2). Это объясняется тем, что атомы ртути могут находиться только в состоянии с энергиями E1, Е2, Е3, и т.д., а воспринимают энергию D Е = Е 2– Е 1. В данном случае D Е =4,9 эВ (электронвольт). Пока энергия электрона
При увеличении ускоряющего потенциала от 0 до 4,9 В гальванометр показал монотонный рост анодного тока. При значениях U³4,9 В (и кратных ему значениях U³ 9,8 В; 14,7 В;…) на кривой I (U) появляются спады (рис.7.2). Это объясняется тем, что атомы ртути могут находиться только в состоянии с энергиями E1, Е2, Е3, и т.д., а воспринимают энергию D Е = Е 2– Е 1. В данном случае D Е =4,9 эВ (электронвольт). Пока энергия электрона 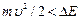 , соударения электронов с атомами упругие, т.е. электрон при соударении не теряет энергию. Поэтому он преодолевает тормозящее поле в области 3 и долетает до анода (ток растет). При
, соударения электронов с атомами упругие, т.е. электрон при соударении не теряет энергию. Поэтому он преодолевает тормозящее поле в области 3 и долетает до анода (ток растет). При 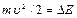 =4,9 эВ соударение электрона с атомом ртути неупругое. Электрон отдает энергию атому и не может преодолеть тормозящее поле. Ток падает.
=4,9 эВ соударение электрона с атомом ртути неупругое. Электрон отдает энергию атому и не может преодолеть тормозящее поле. Ток падает.
Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,9 эВ – наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Атом ртути при этом переходит в новое стационарное состояние (возбужденное). В этом состоянии атом может находиться время Dt» 10-8 c, после чего вновь возвращается в состояние с энергией Е1, испуская квант с частотой 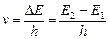 . Значение длины волны l=с/u=253,7 нм оказалось в соответствии со вторым постулатом Бора:
. Значение длины волны l=с/u=253,7 нм оказалось в соответствии со вторым постулатом Бора: 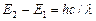 , где Е 1, Е 2–энергии основного и возбужденного уровней энергии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.
, где Е 1, Е 2–энергии основного и возбужденного уровней энергии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала экспериментальную проверку.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 1248; Нарушение авторских прав?; Мы поможем в написании вашей работы!