
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коэффициент активности и ионная сила
|
|
|
|
Заряженные частицы (ионы) в растворе взаимодействуют друг с другом за счет электростатических сил, что приводит к существенному отличию свойств реальных растворов от идеальных, где такое взаимодействие отсутствует. Каждый ион в растворе окружен так называемой «ионной атмосферой», которая состоит из частиц противоположного знака и плотность которой зависит как от заряда иона z, так и от ионной силы раствора I (присутствия всех заряженных частиц в растворе). Наличие такой «ионной атмосферы» и приводит к тому, что свойства реальных растворов определяет не общая концентрация иона, а ее активная часть, которую называют активностью (а). Активность связана с общей концентрацией иона формальным соотношением:
ai = γ i∙сi, где: γ i – коэффициент активности иона.
Коэффициенты активности могут быть меньше единицы или равны единице, в зависимости от концентрации раствора, заряда иона и присутствия других заряженных частиц в растворе, поэтому активность может быть больше, меньше или равна концентрации.
Для расчета ионной силы раствора обычно используют выражение:
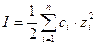
где: ci – молярная концентрация иона, моль/л;
zi – заряд иона
При расчете ионной силы раствора вклад слабых электролитов не учитывается, так как он незначителен.
Зная заряд иона и ионную силу раствора можно по специальным таблицам определить коэффициент активности данного иона в воде при 250С, либо рассчитать его по уравнениям Дебая-Хюккеля:
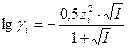 , при 0,01 < I < 0,1
, при 0,01 < I < 0,1
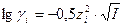 , при I < 0,01
, при I < 0,01
 Например, коэффициенты активности ионов натрия и сульфатных ионов в 0,01 М растворе Na2SO4 в 0,05 М ацетатном буфере (0,05 М CH3COOH + 0,05 M CH3COONa) можно рассчитать следующим образом (при расчете ионной силы вклад слабой уксусной кислоты не учитывается):
Например, коэффициенты активности ионов натрия и сульфатных ионов в 0,01 М растворе Na2SO4 в 0,05 М ацетатном буфере (0,05 М CH3COOH + 0,05 M CH3COONa) можно рассчитать следующим образом (при расчете ионной силы вклад слабой уксусной кислоты не учитывается):
I = 0,5∙(2∙0,01∙12 + 0,01∙22 + 0,05∙12 + 0,05∙12) = 0,08
В сильно разбавленных растворах (сi → 0), в которых ионная сила мала (I → 0), коэффициент активности γ i → 1 и аi → сi, то есть свойства бесконечно разбавленных растворов приближаются к свойствам идеальных растворов.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 367; Нарушение авторских прав?; Мы поможем в написании вашей работы!