
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные равновесия в водных растворах. Водородный показатель рН и кислотность среды. Контроль за кислотностью среды
|
|
|
|
Кислотно-основное (или протолитическое) равновесие – это равновесие в котором участвует протон (ион водорода Н+). При этом в равновесии участвуют вещества способные отдавать и принимать протоны. В соответствие с протолитической теорией Бренстеда и Лоури все частицы, способные при ионизации отщеплять протон, называются кислотами, все частицы, способные присоединять протон – основаниями. Кислоты и основания могут быть нейтральными молекулами или заряженными частицами (катионы и анионы).
Примерами кислот в рамках этой теории являются:
HCN (к) ↔ H+ + CN- (осн)
HS- (к) ↔ H+ + S2- (осн)
Примерами оснований:
CN- (осн) + H+ ↔ HCN (к)
NН3 (осн) + H+ ↔ NH4+ (к)
Как видно из приведенных примеров, в результате отщепления протона от кислоты образуется частица, способная принимать протон (основание), а при присоединении протона к основанию образуется кислота. Такие кислоты и основания, находящиеся в кислотно-основном равновесии, называются сопряженными, то есть HCN и CN- - сопряженные кислота и основание, аммиак и ион аммония – сопряженные основание и кислота.
Некоторые вещества способны как отдавать, так и принимать протоны, то есть одновременно проявлять как кислотные, так и основные свойства:
НСО3- ↔ Н+ + СО32-
НСО3- + Н+ ↔ Н2СО3
Такие вещества называются амфолитами (амфотерными веществами). К амфолитам относится и вода, молекулы которой способны либо отдавать протоны:
Н2О ↔ Н+ + ОН- (CN- + H2O ↔ HCN + OH-)
либо присоединять их:
Н2О + Н+ ↔ Н3О+ (HCN + H2O ↔ H3O+ + CN-)
Таким образом, согласно современным представлениям в воде осуществляется протолитическое равновесие – автопротолиз воды:
Н2О + Н2О ↔ Н3О+ + ОН- или упрощенно: Н2О ↔ Н+ + ОН-
Вода – слабый электролит и диссоциация ее молекул характеризуется концентрационной константой диссоциации, которая имеет вид:
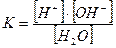
При температуре 298 K (250С) значение 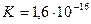 , а молярная концентрация воды в чистой воде
, а молярная концентрация воды в чистой воде
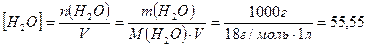 моль/л
моль/л
Тогда имеем
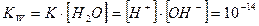
Величина KW называется константа автопротолиза воды или ионное произведение воды. При повышении температуры степень ионизации воды увеличивается и значение константы автопротолиза растет.
Если для величин, входящих в выражение ионного произведения воды, использовать их показатели (отрицательные десятичные логарифмы), то получим:
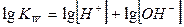
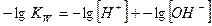
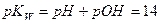
Где 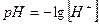 - водородный показатель,
- водородный показатель, 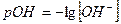 - гидроксильный показатель.
- гидроксильный показатель.
В чистой воде, где концентрации ионов водорода и гидроксида одинаковы 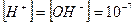 , имеем нейтральную среду (рН = 7); в кислых водных растворах
, имеем нейтральную среду (рН = 7); в кислых водных растворах 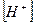 >
>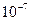 (рН < 7), в щелочных -
(рН < 7), в щелочных - 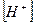 <
<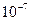 (рН > 7).
(рН > 7).
Таким образом, величина рН может использоваться для характеристики кислотности среды: если рН < 3 - раствор сильнокислый, при 4 < рН < 7 – слабокислый; для слабощелочных растворов характерно значение рН от 7 до 10, а для сильнощелочных – рН > 11.
Для контроля за кислотностью среды при проведении химических реакций используют кислотно-основные индикаторы.
Индикаторы представляют собой слабые органические кислоты (HInd) или основания (IndOH), молекулярная и диссоциированная (ионная) формы которых имеют разную окраску, например, для лакмуса:
HInd (красный) ↔ H+ + Ind- (синий)
При изменении кислотности среды (изменении рН) меняется соотношение между концентрациями окрашенных форм индикатора и раствор принимает ту или иную окраску – в кислой среде лакмус окрашивает раствор в красный цвет (сдвиг равновесия диссоциации влево), а в щелочной – в синий (сдвиг – вправо).
Каждый индикатор характеризуется интервалом перехода окраски (ИПО), который зависит от природы индикатора, и представляет собой область рН, в которой происходит изменение окраски индикатора.
ИПО для некоторых индикаторов приведены в таблице:
| Индикатор | ИПО | Изменение окраски |
| Метиловый оранжевый (метилоранж) | 3,0 ÷ 4,4 | красный – желтый |
| Метиловый красный (метилрот) | 4,2 ÷ 6,2 | красный – желтый |
| Лакмус | 6,0 ÷ 8,0 | красный – синий |
| Фенолфталеин | 8,0 ÷ 10,0 | бесцветный - красный |
Используя разные индикаторы с достаточной точностью можно определить кислотность среды, например, если лакмус в растворе имеет синюю окраску, а фенолфталеин бесцветный, то раствор слабощелочной (рН ~ 8).
В лабораторной практике удобно определять кислотность среды с помощью универсальной индикаторной бумаги, которая изменяет свою окраску в зависимости от рН раствора – красная в кислых, бледно-зеленоватая в нейтральной и синяя в щелочных средах. Сравнивая окраску индикаторной бумаги с эталонной цветовой шкалой можно определить рН реакционной смеси с точностью до единицы.
|
|
|
|
|
Дата добавления: 2013-12-12; Просмотров: 604; Нарушение авторских прав?; Мы поможем в написании вашей работы!