
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализ
|
|
|
|
Кинетика гетерогенных реакций
Физико-химический смысл энергии активации.
Экзотермия (выд. Q) Эндотермия (поглащ. Q)

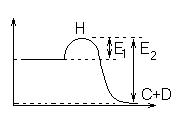

Н – энергетическая величина, которую нужно преодолеть, чтобы реакция пошла.
При переходе системы из состояния 1 в состояние 2 она преодолевает энергетический барьер. И его преодолевают только те молекулы, которые обладают достаточной энергией активации.
Зависимость константы скорости от обратной 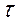

графическое изображение энергии активации
Три стадии гетерогенных реакций:
1. Подвод исходных веществ к межфазной границе (опр. законами диффузии)
2. Химическое превращение определяется законами химической кинетики
3. Отвод продуктов реакции от межфазной границы (опр. законами диффузии)
Стадии протекают последовательно.
Скорость самой медленной стадии и определяет общую скорость процесса.
При низких температурах наиболее медленная стадия – химическое превращение
При высоких температурах – лимитирующая стадия (диффузия)
Температура больше влияет на скорость реакции, чем на скорость диффузии.
Катализ - изменение скорости реакции под действием особых веществ (катализаторов)
Увеличение скорости химической реакции – катализ.
Уменьшение скорости – антикатвлиз
Вещества ингибиторы (расходуемые вещества)
Катализаторы не оказывают влияния на свободную энергию.
Используя катализатор нельзя сместить полож. химической реакции можно лишь ускорить достижение этого.
Применяя катализатор невозможно увеличить выход водного продукта, но можно его получить за значительно меньший промежуток времени.
Катализаторы обладают селективными свойствами:
 кат.
кат. 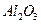
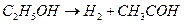 кат.
кат. 
 этилацетат
этилацетат
Существует катализ

 гомогенный и гетерогенный
гомогенный и гетерогенный
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 380; Нарушение авторских прав?; Мы поможем в написании вашей работы!