
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграмма P,t - воды
|
|
|
|
С=К-Ф+П С – число степеней свободы, П – число независимых переменных
Правило фаз Гибса
Правило фаз
Физико-химический анализ
Дает наиболее полную характеристику системы. Химический анализ говорит о химическом составе системы и ничего не говорит о количестве фаз и характере их взаимодействия в системе.
Компоненты системы – химические вещества, которые могут существовать в изолированном виде и определять состав системы.
Число степеней свободы – вариабельность системы; число независимых друг от друга факторов равновесия (число факторов, которые можно менять произвольно, не нарушая состояния системы)
Независимые компоненты – наименьшее число которых достаточно для образования всех фаз системы.
Ф – фазы, К – число компонентов
Пример: Максимальное число фаз? поваренная соль в воде; Фmax=Cmin
Cmin=0 C=R-A+2 Фmax=2+2=4
Фаза 1 – раствор, Фаза 2 – осадок соли, Фаза 3 – водяной пар, Фаза 4 – лед
0 – тройная точка воды 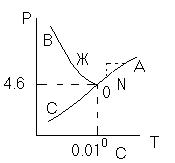
0А – равновесие (жидкость - пар)
0В – Жидкость - лед
0С – пар-лед (испарение)
Число степеней свободы: С=К-Ф+2; С=3-Ф (1 компонент)
Если мы увеличим Р, то увеличим Т, N – останется на
кривой
0 – точка конвариантного равновесия
Классификация диаграмм. Составляется по признаку образования фаз в твердом состоянии.
Термографический анализ
Диаграмма состояния (плавкости) – частный случай диаграммы состояния.
Диаграммы плавкости строятся: Тплав, состав
При построении таких диаграмм строятся кривые охлаждения / нагревания

 время
время
Это и есть термографический анализ (построение кривых  )
)
1) Если система не испытывает фазовых переходов на заданном интервале температур, то
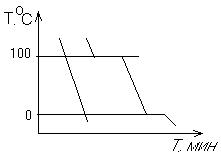
2) Если вещество испытывает фазовые переходы на заданном интервале температур (пример: охлаждение пара)
Изгибы на кривых охлаждения появляются за счет выделения, поглащения тепла при фазовых переходах.
Вынужденная эфтетика
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 496; Нарушение авторских прав?; Мы поможем в написании вашей работы!