
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Избыточные электроны перейдут с электрода
|
|
|
|
Теория гальванического элемента.
Количество ионов, которые
Металлы в растворе собственной соли.
будут взаимодействовать с
раствором соли будет меньше
т.к. соль уже содержит некот.
количество ионов этого
металла.
Зависит какой металл и какая концентрация металла в соли, поведение металла. Например: медь из раствора соли перейдет в электрод, т.е. имеются в виду положительные ионы.
цинка к электроду меди, следовательно
нарушится химическое равновесие
Для того, чтобы компенсировать убыль электронов с цинкового электрода, нужно чтобы цинк растворялся в соли.
Процесс окисления цинка. Процесс восстановления меди
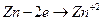
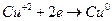
По мере протекания электрического тока в банке с цинком будет недостаток 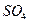 , а в правом избыток, следовательно, будет разница в концентрации ионов
, а в правом избыток, следовательно, будет разница в концентрации ионов 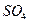
Ионы с большей концентрацией будут переходить в банку с меньшей, т.к. перегородка пористая и имеет место диффузия.
Гальванический элемент – любое устройство, позволяющее получать электрический ток, за счет протекания химических реакций.
Гальваническая цепь – последовательная совокупность скачков потенциала на границе раздела фаз. 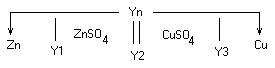
Максимальная разность потенциалов, отвечающая обратимому протеканию химической реакции – ЭДС (Е)
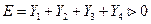
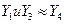
 - очень мала и ей обычно пренебрегают
- очень мала и ей обычно пренебрегают
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 376; Нарушение авторских прав?; Мы поможем в написании вашей работы!