
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксиди
|
|
|
|
Закон Гей-Люсака
При сталому тискові об’єм газу змінюється пропорційно абсолютній температурі (Т): 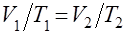 або V/T = const.
або V/T = const.
Об’єднаний закон Бойля-Маріота та Гей-Люсака

Цей закон часто використовують для приведення об’єму до норма-льних умов:  ,
,
де p0, V0, T0 – відповідно тиск, об’єм і температура за нормальних умов (р0 = 101325 Па, T0 = 273К).
Рівняння Менделєєва-Клапейрона
РV = nRT або  ,
,
де n - число молів газу; m – маса газу, кг; р – тиск газу, Па; М – молярна маса газу, кг/моль; V – об’єм газу, м3; Т – температура, К; R – універсальна газова стала (R = 8,314 Дж/(моль×К)).
Правило Дюлонга та Пті
Атомна теплоємність більшості простих речовин у твердому стані приблизно однакова для всіх елементів і дорівнює 26 кДж/(кг × К). Звідси можна визначити атомну масу невідомої простої речовини з формули:
С = сА, де С і с – атомна та питома теплоємності; А – атомна маса.
Тема 2. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
Оксиди – це сполуки, молекули яких складаються з двох елементів, один із яких кисень. Загальна формула оксидів ЕхОу. Оксиди поділяють на основні: Na2O, CaO, FeO, La2O3, тощо; кислотні: CO2, N2O5, Mn2O7, тощо; амфотерні: BeO, ZnO, Al2O3, VO2, тощо та несолетворні: N2O, NO.
Якщо елемент, що утворює оксид, може перебувати у різних станах окисленості, то після назви оксиду латинською цифрою в дужках зазнача-ють ступінь окислення елемента. Наприклад: CaO – оксид кальцію, Fe2O3
– оксид заліза (ІІІ), SnO2 – оксид олова (IV) SO3 – оксид сірки (VI), Mn2O7 – оксид мангану (VIІ).
Способи одержання оксидів
1. Взаємодія елементів з киснем:
2Са + О2 ® 2СаО; 4Р + 5О2 ® 2Р2О5;
4Fe + 3O2 ® 2Fe2O3; 2H2 + O2 ® 2H2O.
2. Розклад гідроксидів (основ, кислот і амфотерних гідроксидів):
Са(ОН)2 – to ® CaO + H2O; 2BiO(OH) – to ® Bi2O3 + H2O;
2H3BO3 – to ® B2O3 + 3H2O; 2Al(OH)3 – to ® Al2O3 + 3H2O.
3. Розклад солей кисневмісних кислот:
СаСО3 Ü to Þ СаО + СО2; 2FePО4 Ü to Þ Fe2О3 + P2O5.
4. Окисленням деяких оксидів, кислот, солей та інших сполук:
2SO2 + O2 – cat ® 2SO3; 4FeO + O2 ® 2Fe2О3;
2H2S + 3O2 ® 2H2О + 2SO2; 4FeS2 + 11O2 ® 2Fe2О3 + 8SO2;
CH4 + 2O2 ® CO2 + 2H2О; CS2 + 3O2 ® CO2 + 2SO2.
Хімічні властивості оксидів
Оксиди, які взаємодіють з кислотами, кислотними оксидами, амфо-терними оксидами та гідроксидами та не взаємодіють між собою назива-ються основними. До основних належать лише оксиди металів.
CaO + 2HCl ® CaCl2 + H2O; Li2O + CO2 ® Li2CO3;
Na2O + 2Al(OH)3 – to ® 2NaAlO2 + 3H2O; MgO + SnO2 ® MgSnO3.
Деякі основні оксиди (як правило лужних і лужноземельних металів) взаємодіють із водою з утворенням відповідних гідроксидів:
Li2O + Н2О ® 2LiOН; ВаO + Н2О ® Ва(OН)2;
Взаємодіють із сильним відновниками:
CuO + H2 ® Cu + H2O; 3FeO + 2Al ® Al2O3 + 3Fe;
Оксиди, які взаємодіють з основами, основними оксидами, амфотер-ними оксидами та гідроксидами та не взаємодіють між собою назива-ються кислотними. До кислотних оксидів належать оксиди неметалів та металів у вищих ступенях окислення: CO2; SO2; SO3; B2O3; N2O3; N2O5; P2O5; P2O3; SiO2; Mn2O7; CrO3; V2O5;.
Деякі кислотні оксиди взаємодіють із водою з утворенням відповід-них кислот:
СО2 + Н2O Û Н2СО3; Mn2O7 + H2O ® 2HMnO4;
SO3 + Н2O ® Н2SО4; CrO3 + H2O ® Н2CrО4;
N2O5 + H2O ® 2HNO3.
Оксиди металів, які мають подвійну природу та взаємодіють як із кислотами та кислотними оксидами так і з гідроксидами та оксидами ме-талів, називають амфотерними оксидами: BeO, ZnO, Al2O3, Fe2O3, VO2.
Наприклад: ZnO + 2HCl ® ZnCl2 + H2O;
ZnO + 2NaOH – to ® Na2ZnO2 + H2O;
або ZnO + 2NaOH + H2O ® Na2[Zn(OH)4];
Також: BeO + SiO2 ® BeSiO3;
BeO + Na2O – to ® Na2BeO2.
За стандартних умов амфотерні оксиди не взаємодіють із водою.
Оксиди, які не взаємодіють із кислотами, гідроксидами металів, кислотними та основними оксидами, водою називаються несолетвірни-ми. Для таких оксидів характерні окисно відновні реакції та реакції ком-плексоутворення (NO, N2O, H2O, CO):
2NO + O2 ® 2NO2; CuSO4 + 5H2O ® [Cu(H2O)4]SO4 × H2O.
Гідроксиди металів
Гідроксиди металів – це складні речовини, у молекулах яких атом металу сполучено з гідроксильними групами (KOH; LiOH; TlOH; Ba(OH)2; Cu(OH)2; Fe(OH)3; Ti(OH)4; тощо). У процесі електролітичної дисоціації гідроксид металу розпадається з утворенням аніонів ОН- та катіонів металу: NaOН «Na+ + OН-;
Сa(OН)2 «СaOH+ + OН-;
CaOH+ + Ca2+ + OH-.
За стосовністю до води гідроксиди поділяють на добре розчинні (їх ще називають лугами): NaOH, KOH, CsOH, Ba(OH)2; та малорозчинні: Mg(OH)2, Fe(OH)2, La(OH)3, Al(OH)3, Fe(OH)3, Sn(OH)4 тощо. У назвах гідроксидів металів змінної валентності валентність металу позначається латинською цифрою у дужках, наприклад Cu(OH)2 – гідроксид міді (ІІ).
Способи одержання гідроксидів
1. Взаємодія водорозчинних солей металів із лугами:
СuSO4 + 2NaОH ® Сu(ОH)2 + Na2SO4;
AlCl3 + 3KОH ® Al(OH)3 + 3KCl.
2. Взаємодія активних металів з водою:
2Nа + 2Н2O ® 2NaOH + H2;
Cа + 2Н2O ® Ca(OH)2 + H2;
3. Взаємодія деяких оксидів металів з водою:
ВаО + Н2O ® Вa(OH)2; Li2O + Н2O ® 2LiOH.
Хімічні властивості гідроксидів металів
Всі гідроксиди взаємодіють з кислотами та кислотними оксидами, утворюючи сіль та воду: NaOH + HNO3 ® NaNO3 + H2O;
3Ca(OH)2 + 2H3PO4 ® Ca3(PO4)2 + 6H2O;
KOH + SO3 ® K2SO4 + H2O;
Ca(OH)2 + CO2 ® CaCO3 + H2O.
Луги взаємодіють із солями з утворенням інших гідроксидів та інших солей: Pb(NO3)2 + 2NaOH ® Pb(OH)2¯ + 2NaNO3;
FeSO4 + 2KOH ® Fe(OH)2¯ + K2SO4.
При нагріванні гідроксиди металів розпадаються на оксид і воду:
Са(ОН)2 – to ® CaO + H2O;
Тi(OH)4 – to ® ТiO2 + 2H2O;
2Al(OH)3 – to ® Al2O3 + 3H2O.
Частина гідроксидів металів реагує як із кислотами так і з лугами, проявляючи амфотерні властивості:
Ве(OН)2 + 2HCl ® ВеCl2 + 2H2O;
Ве(OН)2 + 2NaOH ® Na2[Ве(OH)4];
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 752; Нарушение авторских прав?; Мы поможем в написании вашей работы!