
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
K l m n o p q
|
|
|
|
Орбітальне квантове число l – характеризує енергію електрона на підрівні або форми електронних орбіталей. Воно також називається ази-мутальним квантовим числом та відповідає значенню орбітального мо-менту кількості руху електрона, який обчислюється за формулою:

Орбітальне квантове число може набувати додатних цілочислових значень від 0 до n – 1. Кожному значенню l відповідає певний електрон-ний підрівень в атомі. Енергетичні підрівні позначаються маленькими ла-тинськими літерами: Орбітальне квантове число 0 1 2 3
Енергетичний підрівень s p d f
Можлива кількість підрівнів для кожного енергетичного рівня дорів-нює номерові цього рівня, тобто величині його головного квантового числа. Так, якщо
n = 1 l = 0 підрівень 1s
n = 2 l = 0; 1 підрівні 2s 2p
n = 3 l = 0; 1; 2 підрівні 3s 3p 3d
n = 4 l = 0; 1; 2; 3 підрівні 4s 4p 4d 4f
Відповідно до квантово-механічних розрахунків s-орбіталі мають форму кулі (сферична симетрія) p-орбіталі форму гантелі d- та f-орбіталі складніші форми.
Магнітне квантове число ml – характеризує просторове розташу-вання електронних орбіталей відносно спрямованості магнітного поля. Магнітне поле орієнтує площину орбіталі у просторі під певними кутами, при яких проекція орбітального моменту Мх на спрямованість поля (на-приклад на вісь абсцис) визначається за формулою:
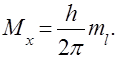
Магнітне квантове число може набувати цілочислових значень від – l до + l.
Отже число значень магнітного квантового числа залежить від орбі-тального квантового числа і показує, скільки може бути орбіталей з певним значенням орбітального квантового числа
l ml кількість орбіталей
0 0 1 (s)
1 –1; 0; +1 3 (рx, py, pz)
2 –2;–1;0; +1; +2 5 (dxy, dxz, dyz, d(x2 – y2), d(z2))
3 –3; –2;–1;0; +1; +2; +3 7
Певному значенню l відповідає (2 l + 1) можливихзначень магнітно-го квантового числа. Орбіталі з однаковою енергією називаються виро-дженими. Тому р-стан вироджений три рази d-стан п’ять разів, а f-стан сім разів.
На відміну від кулястої s-орбіталі p-, d- та f-орбіталі у просторі мають певний напрямок. За характером орієнтації у просторі p- орбіталі позначають рx, py, pz, які витягнуті відповідно вздовж осей x, y та z.



 l = 1 ml = –1 x
l = 1 ml = –1 x  ml = 0
ml = 0  ml = +1
ml = +1 
Кожну орбіталь іноді зображують як енергетичну (квантову) комір-ку у вигляді клітинки. Для s-електронів може бути лише одна орбіталь або одна енергетична комірка, для p-електронів – 3, для d-електронів – 5 та f-електронів – 7.
Спінове квантове число ms. На основі вивчення тонкої структури атомних спектрів встановлено, що стан електрона в атомі, крім обертання навколо ядра, яке визначається квантовими числами n, l, ml, залежить також від власного обертального моменту електрона – спіну. Спрощено спін можна уявити як обертання електрона навколо своєї осі. Цей рух електрона характеризується спіновим квантовим числом ms, яке може на-бувати лише двох значень: +½ або –½. Спін електрона зображують верти-кально напрямленими стрілочками: або ¯ відповідно. Співнапрямлені спіни електронів називаються паралельними, протилежно напрямлені спіни називаються антипаралельними. В одній квантовій комірці (чи на одній орбіталі) можуть перебувати електрони лише з протилежно напрям-леними спінами.
5. ПРИНЦИП ПАУЛІ
Згідно з принципом Паулі, в атомі не може бути двох електронів з однаковими значеннями всіх чотирьох квантових чисел.
Суть принципу Паулі полягає в тому, що одну орбіталь, яка характеризується певними значеннями n, l, ml можуть займати не більш як два електрони з антипаралельними спінами.
Число можливих енергетичних станів електронів на певному рівні визначається квадратом головного квантового числа n2, а максимальне число електронів на ньому дорівнює 2 n2 (табл. 1).Отже на:
І енергетичному рівні – 1 орбіталь – 2 електрони;
ІІ енергетичному рівні – 4 орбіталі – 8 електронів;
ІІІ енергетичному рівні – 9 орбіталей – 18 електронів;
ІV енергетичному рівні – 16 орбіталей – 32 електрони.
Розподіл електронів на енергетичних рівнях і підрівнях записується так: великою арабською цифрою позначається номер енергетичного рів-ня, маленькими латинськими літерами позначаються підрівні, а число електронів на підрівні – маленькою арабською цифрою у верхньому правому індексі.
6. ПОСЛІДОВНІСТЬ ЗАПОВНЕННЯ ЕЛЕКТРОНАМИ ЕНЕРГЕТИЧНИХ РІВНІВ У БАГАТОЕЛЕКТРОННИХ АТОМАХ
Послідовність заповнення атомних електронних орбіталей залежно від значень головного та орбітального квантових чисел дослідив радянський вчений В.М.Клечковський. Він встановив, що енергія зростає зі збільшенням суми цих двох квантових чисел, тобто величини (n + l). Відповідно до цього він сформулював положення (перше правило Клеч-ковського): при збільшенні заряду ядра атома послідовне заповнення електронних орбіталей відбувається від орбіталей із меншим значенням суми головного та орбітального квантових чисел (n + l) до орбіталей із більшим значенням цієї суми.
При однакових величинах суми (n + l) енергія електрона тим вища, чим більше значення головного квантового числа n. Тому в подібних ви-падках порядок заповнення електронами енергетичних комірок визнача-ється другим правилом Клечковського: при однакових значеннях суми (n+l) заповнення електронних орбіталей відбувається послідовно у напря-мі зростання головного квантового числа n.
У багатоелектронних атомах заповнення електронами всіх енерге-тичних рівнів і підрівнів відбувається у такій послідовності: 1s ® 2s ® ®2p ® 3s ® 3p ® 4s ® 3d ® 4p ® 5s ® 4d ® 5p ® 6s ®(5d1) ® 4f ® 5d ® 6p ® 7s ® (6d1-2) ® 5f ® 6d ® 7p ® 8s….
Заповнення електронами еквівалентних орбіталей відбувається згід-но з правилом Гунда: сумарне спінове число електронів певного підрівня повинно бути максимальним. Наприклад, якщо атом має три електрони на р-підрівні, то вони розміщуються по одному електронові на кожній із трьох р-орбіталей. При іншому розміщенні електронів (двох на одній ор-біталі, а третього на іншій, сумарне спінове число буде менше ніж у пер-шому варіанті: І S ms = 1 ½
IІ ¯ S ms = ½.
Іншими словами електрони певного підрівня займають максимально можливу кількість еквівалентних орбіталей. При цьому на орбіталях роз-міщуються електрони з паралельними спінами, після чого послідовно заповнюються орбіталі електронами з антипаралельними спінами до вже розміщених електронів підрівня. Наприклад, якщо атом елемента на р-підрівні має чотири електрони, то вони розміщуються наступним чином: 7. ЕЛЕКТРОННІ СТРУКТУРИ АТОМІВ І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ Будова електронних рівнів і підрівнів у атомах залежить від положення елемента у періодичній системі Д.Менделєєва. У перших трьох періодах зі збільшенням заряду ядра атомів елемен-тів відбувається заповнення електронами зовнішнього енергетичного рівня. Так перший період складається з двох елементів. У атома водню один електрон розміщується на s-підрівні К-рівня (n = 1): 1Н; 1s1; . Атом гелію (Z = 2) має два електрони. Згідно принципу Паулі вони характеризуються антипаралельними спінами: 2Не; 1s2; ¯. Елементи, в атомах яких заповнюються електронами s-орбіталі нази-ваються s-елементами. Другий та третій періоди містять по вісім елементів. В елементів другого періоду відбувається забудова L-рівня (n = 2). В атомах перших двох елементів Lі та Ве заповнюються 2s-орбіталі, а у В – Nе послідовно 2р-орбіталі. Нижче наведено електронні формули та схеми електронної будови атомів деяких елементів: 6С – 1s22s22p2 7N – 1s22s22p3 8О – 1s22s22p4 s p s p s p В атомі неону (Z = 10) закінчується забудова 2р-орбіталей, і другий енергетичний рівень заповнюється максимально можливим числом електронів, які утворюють високо симетричну структуру: 10Nе – 1s22s22p6. Атомом неону завершується другий період системи елементів і забудова енергетичного L-рівня. Елементи, в атомах яких заповнюються електро-нами р-орбіталі називаються р-елементами. Отже другий період склада-ється з двох s-елементів та шести р-елементів. В атомів елементів третього періоду заповнюється електронами М-рівень (n = 3), який складається з 3s-, 3p- та 3d-орбіталей. В атомах пер-ших двох елементів Na та Mg заповнюються електронами 3s-орбіталі, у Al – Ar – 3р-орбіталі, а 3d-орбіталі лишаються вакантними. Наводимо електронні формули та схеми будови атомів деяких елементів: 11Na 1s22s22p63s1([Ne]3s1) 15P – 1s22s22p63s23p3 18Ar – 1s22s22p63s23p6 s p s p s p Атом аргону – останній елемент третього періоду – має повністю заповнені 3s- і 3р-орбіталі, тобто зовнішній енергетичний рівень склада-ється з чотирьох пар спарених електронів. Отже третій період також міс-тить два s-елементи та шість р-елементів. У четвертому й п’ятому періодах міститься по вісімнадцять елемен-тів В атомів елементів четвертого періоду відбувається забудова N-рівня (n = 4). В атомах перших двох елементів К та Сa заповнюються 4s-орбіталі, вакантну 3d-орбіталь екрановано електронним шаром 3s23p6. За-вдяки відштовхуванню від цього шару 19-го електрона атома К та 20-го електрона атома Са енергетично більш вигідний 4s ніж 3d-стан. Крім того, для 3d-орбіталей (n = 3, l = 2) сума n + l = 5, а для 4s (n = 4, l = 0) сума n + l = 4, тому 4s-орбіталі мають заповнюватись електронами рані-ше ніж 3d, що і спостерігається: 19К – 1s22s22p63s23p64s1 ® [Ar]4s1; 20Ca – 1s22s22p63s23p64s2 ® [Ar]4s2. Починаючи з елемента четвертого періоду третьої групи – скандію відбувається забудова 3d-орбіталей, яка завершується в атомі міді. Наво-димо приклади електронних формул атомів елементів четвертого періоду: 21Sc – 1s22s22p63s23p63d14s2 ® [Ar]3d14s1; 24Cr – 1s22s22p63s23p63d54s1 ® [Ar]3d54s1; 29Cu – 1s22s22p63s23p63d104s1 ® [Ar]3d104s1; 30Zn – 1s22s22p63s23p63d104s2 ® [Ar]3d104s2. Елементи, в атомах яких електронами заповнюються d-орбіталі на-зиваються d-елементами або перехідними елементами. Після заповнення 3d- та 4s-орбіталей відбувається забудова 4р- орбіталей в атомів елементів Ga – Kr. Четвертий завершується інертним газом – криптоном, атом якого має всів спарені електрони: 36Kr – 1s22s22p63s23p63d104s24р6 ® [Ar]3d104s24р6. Отже, четвертий період починається з двох s-елементів, а закінчу-ється шістьма р-елементами, а між ними розміщено 10 d-елементів. У п’ятому періоді заповнення енергетичних рівнів і підрівнів відбу-вається аналогічно четвертому періодові: в атомів двох перших елементів Rb та Sr заповнюється 5s-орбіталь, в атомів елементів Y – Cd – 4d-орбі-талі, а в In – Xe – 5p-орбіталі. Отже, п’ятий період містить два s-елементи, 10 d-елементів та шість р-елементів. Шостий період, що місить 32 елементи, починається двома s-елемен-тами: Cs та Ва, в атомах яких заповнюється 6s-орбіталь. В атома елемента лантану починається забудова 5d-орбіталей (один електрон), а в атомів елементів Ce – Lu 4f-стан більш енергетично вигідний ніж 5d-. Тому в атомів елементів Ce – Lu відбувається забудова 4f-орбіталей. Крім лантану на 5d-орбіталях по одному електрону мають атоми гадолінію та лютецію. Після заповнення 4f-орбіталей триває заповнення 5d-орбіталей в атомів елементів Hf – Au, і цей період завершується елементами Tl – Rn, в атомах яких забудовуються 6p-орбіталі. Наводимо приклади скорочених електронних формул атомів елементів п’ятого періоду: 55Cs – [Xe]6s1; 57La – [Xe]5d16s2; 71Lu – [Xe]4f145d16s2; 79Au – [Xe]4f145d106s1; 86Rn – [Xe]4f145d106s24p6. Елементи, в атомах яких електронами заповнюються f-орбіталі на-зиваються f-елементами. Отже, шостий період складається з 2-х s-елемен-тів, чотирнадцяти f-елементів, десяти d-елементів та шести р-елементів. Сьомий період ще не завершений. Заповнення енергетичних рівнів і підрівнів відбувається аналогічно тому, як і в атомів шостого періоду. У атомів двох перших елементів Fr та Ra заповнюється 7s-орбіталь. В атома актинію один електрон розміщується на 6d-орбіталі, а в атомів елементів Th – Lr відбувається забудова 5f-орбіталей. По одному електрону на 6d-орбіталях крім актинію містять атоми торію, протактинію, урану, непту-нію, плутонію, америцію, кюрію, берклію, лоуренсію. 8. АТОМНЕ ЯДРО Атомне ядро є основою атома, що визначає індивідуальність хіміч-ного елемента. Відповідно до сучасних уявлень атомні ядра складаються з елементарних частинок: протонів (р) і нейтронів (n), які об’єднують під загальною назвою – нуклони. Протон – стабільна елементарна частинка, маса спокою якої дорів-нює 1,673 × 10-24 г, відносна атомна маса – 1,00727 а.о.м., з додатнім зарядом (+1), спіном ½ та магнітним моментом, що дорівнює 2,79 ядерно-го магнетона. Нейтрон – стабільна електронейтральна елементарна частинка з масою спокою 1,675 × 10-24 г, відносна атомна маса – 1,008665 а.о.м., без електричного заряду, зі спіном ½ та магнітним моментом, що дорівнює 1,91 ядерного магнетона. Властивості ядра зумовлені його складом – числом протонів (Z) та числом нейтронів (N), які входять до складу ядра та визначають його масове число А = Z + N. Оскільки число протонів у ядрі дорівнює величині його позитивного заряду, тобто порядковому номерові елемента, число нейтронів дорівнює різниці між масовим числом і порядковим номером елемента. 9. ЕНЕРГІЯ ЙОНІЗАЦІЇ, СПОРІДНЕНІСТЬ ДО ЕЛЕКТРОНА, ЕЛЕКТРОНЕГАТИВНІСТЬ Хімічна природа елемента зумовлена здатністю його атомів прийма-ти чи віддавати електрони. Цю здатність кількісно характеризують величини енергії йонізації (І) та спорідненості до електрона (F). Енергію йонізації виражають у кДж/моль чи еВ/атом. Величина І служить металевих властивостей елементів. Чим менша величина І, тим більше металеві властивості атомів елемента. У коротких періодах зліва направо енергія йонізації збільшується, отже металеві властивості еле-ментів послаблюються. У головних підгрупах кожної з груп періодичної системи зі збільшенням порядкового номера енергія йонізації зменшуєть-ся, а металеві властивості посилюються.
¯
n = 2
¯
¯
¯
n = 2
¯
¯
¯
¯
n = 2
¯
¯
¯
¯
n = 1
¯
n = 1
¯
n = 1
¯
n = 3
¯
n = 3
¯
¯
¯
¯
n = 2
¯
¯
¯
¯
Енергія йонізації
– це кількість енергії, яку необхідно затратити для відриву електрона від електронейтрального атома із перетворенням його у додатньо заряджений іон: А0 + І ® А+ + е-.Спорідненість до електрона
– це кількість енергії, яка виділяється чи поглинається при приєднанні електрона до електронейтрального атома із перетворенням його у від’ємно заряджений іон: А0 + е- ® А- + F.
Цю величину також виражають у кДж/моль чи еВ/атом. Спорідне-ність до електрона – міра неметалевих властивостей атомів елементів. Чим більша спорідненість до електрона, тим яскравіше виражено немета-леві властивості. У періодах зліва направо спорідненість до електрона збільшується – неметалеві властивості елементів посилюються. У голов-них підгрупах зі збільшенням порядкового номера ця величина зменшу-ється – неметалеві властивості послаблюються.
Електронегативність (ЕН) – це здатність атомів у сполуці притягувати до себе електрони інших атомів. Чисельно електронегатив-ність дорівнює півсумі енергій йонізації та спорідненості до електрона:
ЕН = (І + F)/2.
У періодах зліва направо електронегативність елементів збільшуєть-ся, а у головних підгрупах зі збільшенням порядкового номера ця величи-на зменшується. При хімічній взаємодії й утворенні хімічних зв’язків електрони зсуваються від атома з меншою електронегативністю до атома з більшою електронегативністю.
Тема 4. ХІМІЧНИЙ ЗВ’ЯЗОК І БУДОВА МОЛЕКУЛ
Під хімічним зв’язком треба розуміти силу, що діє між атомами та єднає їх у молекули чи кристали. Природа хімічного зв’язку є електрич-ною. Це означає, що хімічний зв’язок виникає завдяки полям, які утворю-ються ядрами атомів, що беруть участь у формуванні молекул чи інших хімічних утворень.
Залежно від характеру розподілу електронної густини у речовині розрізняють такі основні типи хімічного зв’язку: ковалентний, іонний та металевий. Для переважної більшості речовин характерне сполучення різних типів зв’язку.
Основні параметри молекул.
Основними параметрами молекули є між’ядерні відстані, енергія зв’язку, валентні кути та геометрія молекул.
Між’ядерні відстані між хімічно зв’язаними атомами називають довжиною зв’язку. Наприклад довжина зв’язку Н – Н дорівнює 0,074 нм. Кут між уявними лініями, які проходять крізь ядра хімічно зв’язаних ато-мів, називається валентним кутом. У молекулі води він дорівнює 104,5о. Мірою міцності зв’язку між атомами в молекулі є кількість енергії, яку необхідно затратити, щоб розірвати зв’язок.
Довжина та енергія зв’язку, валентні кути, а також експерименталь-но визначені оптичні, магнітні, електричні та інші властивості речовини безпосередньо залежать від характеру розподілу електронної густини в молекулі та зумовлюють її геометрію.
КОВАЛЕНТНИЙ ЗВ’ЯЗОК
Необхідною й достатньою умовою утворення ковалентного зв’язку є наявність електронів із протилежними спінами атомів.
Розглянемо механізм утворення ковалентного зв’язку на прикладі молекули водню, яка утворюється з двох атомів На та Нб. Хімічний зв’я-зок між атомами може виникнути тільки у тому випадку, якщо при зближенні атомів потенціальна енергія системи буде менше потенціальної енергії окремих атомів. Розглянемо випадок коли зближуються два атоми водню, електрони яких мають антипаралельні спіни.
 r = 0,053 нм l = 0,074 нм
r = 0,053 нм l = 0,074 нм
 |  | ||
На Нб Н2
Схематично зміну потенціальної енергії (Е) системи у залежності від відстані між атомами (r) зображено на мал. Х.
Спочатку переважають сили притягання – потенціальна енергія зменшується. При подальшому зближенні атомі між ними виникають сили відштовхування. Мінімум енергії (енергії зв’язку) відповідає такому станові системи, коли сили притягання та відштовхування зрівноважені. Після цього сили відштовхування переважують, що призводить до різкого збільшення енергії системи (крива 1 на мал.4.1).
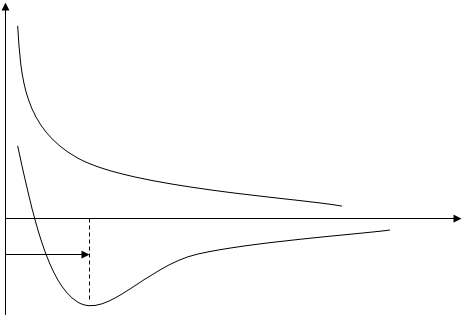 E
E
2 (↑↑)
R0R, нм
Езв. 1 (↑↓)
Мал.4.1. Зміна потенціальної енергії залежно від відстані між атомами.
Значення r0 відповідає довжині зв’язку й дорівнює для молекули водню 0,074 нм; енергія зв’язку становить 4,5 еВ. Утворення молекули водню супроводжується, крім зміни енергії системи, зміною густини електронних хмар. При утворенні ковалентного зв’язку відбувається перекривання електронних хмар атомів водню, тобто у молекули водню змінюється густина електронних хмар порівняно з густиною електронної хмари ізольованого атома водню.
Ковалентний зв’язок – це зв’язок, що утворюється внаслідок сполучення електронних оболонок взаємодіючих атомів.
Якщо зближуються атоми, електрони яких мають паралельні спіни, то в цьому випадку переважають силив відштовхування – потенціальна енергія зростає. Молекула не утворюється (крива 2 на мал.4.1). Ковалент-ний зв’язок можна умовно позначити так:
Н: Н або Н – Н;
H: Cl або Н – Cl;
N MM N або N º N.
Характерні властивості ковалентного зв’язку.
До них відносяться насиченість, напрямленість і поляризованість. Насиченість виражається в обмеженні ковалентних зв’язків, що може утворити атом даного елемента. Число ковалентних зв’язків, які утворює атом називають ковалентністю. Валентність визначається кількістю не-збуджених електронів або утворює при своєму збудженні.
Збудження атома досягається переходом електронів з одного підрів-ня на інший (з вищою енергією) за рахунок зовнішнього енергетичного чинника. Розглянемо основний та збуджений стани деяких елементів другого й третього періоду періодичної системи:
3Li – 1s22s1 B = 1 (у збудженому та незбудженому станах);
4Ве – 1s22s2 B = 0 (у незбудженому стані);
4Ве* – 1s22s12p1 В = 2 (у збудженому стані);
5В – 1s22s22p1 В = 1 (у незбудженому стані);
5В* – 1s22s12p2 В = 3 (у збудженому стані);
Атоми елементів третього періоду на зовнішньому енергетичному рівні мають вакантний d-підрівень на який при збудженні можуть переходити s- та p-електрони зовнішнього рівня. При цьому з’являється додаткова можливість збільшення числа неспарених електронів. Так, на-приклад, атом хлору в основному стані має один неспарений електрон і при затраті енергії може бути переведений у збуджений стан, який харак-теризується наявністю трьох, п’яти й семи неспарених електронів:
17Cl – 3s23p5 В = 1 (у незбудженому стані);
17Cl * – 3s23p43d1 В = 3 (у збудженому стані);
17Cl ** – 3s23p33d2 В = 5 (у збудженому стані);
17Cl *** – 3s13p43d3 В = 7 (у збудженому стані);
Донорно-акцепторний механізм утворення ковалентного зв’язку.
У багатьох випадках ковалентні зв’язки утворюються не внаслідок спарювання електронів різних атомів, а за рахунок неподіленої електрон-ної пари, яка знаходиться на зовнішньому енергетичному рівні певного атома. Розглянемо донорно-акцепторний механізм утворення ковалентно-го зв’язку на прикладі взаємодії аміаку з катіоном водню:
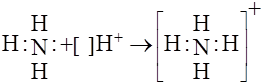
У молекулі аміаку з восьми зовнішніх електронів атома шість утво-рюють три ковалентні зв’язки і є загальними для атомів азоту та водню. Проте два електрони належать лише атомові азоту та називаються непо-діленою електронною парою. Така пара електронів може брати участь в утворенні ковалентного зв’язку з іншими атомами, якщо останні мають на зовнішньому енергетичному рівні вільну орбіталь. Вільну 1s-орбіталь має наприклад іон водню Н+. Тому при взаємодії молекул аміаку з катіо-ном водню між ними виникає ковалентний зв’язок за рахунок неподіленої електронної пари атома азоту та вільної орбіталі йона водню. При цьому утворюється катіон амонію.
Такий механізм утворення ковалентного зв’язку називається донор-но-акцепторним. Атом, який віддає свою неподілену електронну пару для утворення зв’язку (атом азоту), називається донором, а атом, який має вільну (вакантну) орбіталь і приймає електронну пару називається акцеп-тором (катіон водню).
Завдяки донорно-акцепторному механізмові утворення зв’язків збільшуються валентні можливості атомів. Наприклад, у молекулі NH3 азот тривалентний, а в іоні NH4+ – чотиривалентний. Це означає, що валентність елемента визначається не тільки числом неспарених електро-нів, як зазначалося раніше, а й наявністю неподілених електронних пар чи вільних орбіталей на зовнішньому енергетичному рівні. Отже, у загально-му випадку валентність (ковалентність елемента визначається числом орбіталей, які використовуються при утворенні хімічного зв’язку.
Напрямленість ковалентного зв’язку.
Відповідно до методу валентних зв’язків хімічний зв’язок між ато-мами зумовлюється перекриванням s-, p-, d- та f-орбіталей, які (окрім s-орбіталей) мають напрямленість у просторі. Тому й хімічні зв’язки, які утворюються за їхньою участю, мають у просторі певну напрямленість. Оскільки електронні орбіталі мають різну форму, то їхнє взаємне пере-кривання може здійснюватись різними способами. Залежно від способу перекривання електронних орбіталей розрізняють s- (сигма) та p- (пі) зв’язки. Сигма-зв’язок здійснюється при перекриванні електронних орбі-талей вздовж лінії, яка з’єднує два ядра атомів. Він може утворюватись за рахунок двох s-електронів, одного s- і одного p-електрона, двох p-елек-тронів, двох d-електронів. Сигма-зв’язок характеризується однією облас-тю перекривання електронних орбіталей, він завжди одинарний, тобто утворюється за рахунок однієї електронної пари (мал.4.2)
Мал. 4.3. Різновиди σ -зв’язків. 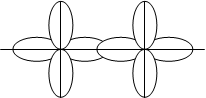


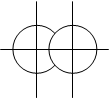
s – s (σ) p – p (σ) d – d (σ)
Пі-зв’язок виникає при перекриванні електронних орбіталей по оби-два боки від лінії, яка з’єднує ядра атомів. Цей зв’язок може утворитись при взаємодії двох електронних орбіталей з двома областями перекриван-ня за рахунок двох р-орбіталей чи двох d-орбіталей (мал.4.3).


p – p (π) d – d (π)
Мал. 4.3. Різновиди π -зв’язків.
Пі-зв’язки мають місце, наприклад у молекулі азоту. У молекулі азо-ту рх-орбіталі утворюють один s-зв’язок при утворенні зв’язку ру- та рz-орбіталями виникають p-зв’язки отже у молекулі азоту з трьох зв’язків один s-зв’язок, а два інші – p-зв’язки. Хімічний зв’язок утворений більш ніж однією електронною парою називається кратним. Підвищення крат-ності зв’язку призводить до перерозподілу міжатомної електронної густи-ни та зменшення між’ядерної відстані (довжини зв’язку). Дельта-зв’язок (d-зв’язок) зумовлений перекриванням усіх чотирьох пелюсток d-елек-тронних орбіталей, розміщених у паралельних площинах.
Гібридизація атомних орбіталей. Просторова конфігурація молекул.
Дж. Слейтер і Л. Полінг пояснили, що явище гібридизації валентних орбіталей полягає в тому, що електронні орбіталі різної симетрії, які не дуже відрізняються за енергією утворюють гібридизовані електронні ор-біталі, які є результатом додавання та усереднення атомних орбіталей. При гібридизації початкова форма й енергія орбіталей взаємно змінюєть-ся й утворюються нові орбіталі, але вже однакової форми й з однаковою енергією. Число гібридизованих орбіталей дорівнює числу орбіталей, які взяли участь у гібридизації. Гібридизовані орбіталі витягнуті в напрямку утворення хімічних зв’язків і тому зумовлюють ліпше перекривання елек-тронних хмар. Внаслідок цього хімічний зв’язок, що утворюється з участю електрона гібридизованої орбіталі, міцніший ніж утворений за рахунок електронів окремих вихідних орбіталей. Тип гібридизації визна-чається типом і кількістю орбіталей, що беруть участь у гібридизації. Якщо гібридизовані орбіталі утворюють одна s- і одна p-орбіталь то такий стан називають sp-гібридизацією, електронні орбіталі sp-гібридизовани-ми, а якщо участь у гібридизації беруть одна s- і три p-орбіталі то кажуть, що має місце sp3-гібридизація та sp3-гібридизовані орбіталі.
Розглянемо sp-гібридизацію на прикладі молекули BeCl2
4Ве – 1s22s2 B = 0 (у незбудженому стані);
4Ве* – 1s22s12p1 В = 2 (у збудженому стані);
При комбінації однієї s- і однієї p-орбіталей виникають дві sp-гібри-дизовані орбіталі із кутом між їхніми осями, що дорівнює 180о (мал.4.4).

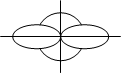 Мал. 4.4. Утворення sp-орбіталей.
Мал. 4.4. Утворення sp-орбіталей.

(s + p) орбіталі дві sp -орбіталі
Зв’язки, які утворюються за участю електронів цих орбіталей, також розташовуються під кутом у 180о. Такий тип гібридизації має місце при утворенні галогенідів елементів ІІ групи періодичної системи: Be, Zn, Cd, Hg, атоми яких у валентному стані мають неспарені s- і p-електрони. В молекула ВеCl2 лінійна просторова конфігурація.
 Cl – Ве – Cl
Cl – Ве – Cl
180o
У молекулах елементів інших груп, наприкл. О = С = О та НС º СН, зв’язки утворено sp-гібридизованими орбіталями атома вуглецю.
Sp2-гібридизація на прикладі молекули BF3.
5В – 1s22s22p1 B = 1 (у незбудженому стані);
5В* – 1s22s12p2 В = 3 (у збудженому стані);
Комбінація однієї s- і двох p-орбіталей призводить до утворення 3 sp2-гібридизованих орбіталей, розташованих під кутом 120о (мал.4.5).

 Мал. 4.5. Утворення sp2-орбіталей.
Мал. 4.5. Утворення sp2-орбіталей.


 120о
120о
 |
(s + p + p) орбіталі три sp2 -орбіталі
Під таким самим кутом розміщуються й зв’язки, утворені електрона- ми цих орбіталей. Такий тип гібридизації характерний для елементів ІІІ групи періодичної системи, атоми яких у збудженому стані мають елек-тронну будову Ns1Np2, що утворюють гібридизовані зв’язки. Молекула ВF3 має форму плоского трикутника внаслідок sр2-гібридизації атома бору: F


 В F
В F
F
У молекулах елементів інших груп, наприкл. О = С = О та НС º СН, зв’язки утворено sp-гібридизованими орбіталями атома вуглецю.
Sp3-гібридизація на прикладі молекули CH4.
6C – 1s22s22p2 B = 2 (у незбудженому стані);
6C* – 1s22s12p3 В = 4 (у збудженому стані);
Комбінація чотирьох орбіталей однієї s- і трьох p-орбіталей призво-дить до sp3-гібридизації, при якій чотири гібридизовані орбіталі симетри-чно орієнтовані у просторі до чотирьох вершин тетраедра, тобто під кутом 109о28¢ (мал.4.6).

 Мал. 4.5. Утворення sp3-орбіталей.
Мал. 4.5. Утворення sp3-орбіталей.


 |
(s + p + p + p) орбіталі чотири sp3 -орбіталі
Тетраедричне розміщення зв’язків і форма тетраедра характерні для багатьох сполук чотиривалентного вуглецю, наприклад у молекулі СН4:
Н
 |
109о28¢
 С
С

 Н
Н
Н Н
Метод гібридизації атомних орбіталей успішно пояснює геометрич-ну будову великого числа молекул, але в деяких випадках теоретичні дані дещо розходяться з експериментами. Наприклад, для молекул СН4, NН3 та Н2О характерне утворення sp3-гібридизованих зв’язків. Тому можна було б чекати, що валентні кути між зв’язками у цих молекул будуть приблизно дорівнювати 109о. Але експериментально встановлено, що ва-лентні кути дорівнюють: Ð НСН = 109о28¢;Ð НNН = 107о18¢;Ð НOН = =104о30¢; Такі відхилення у молекул NН3 та Н2О метод валентних зв’язків пояснює наявністю неподілених електронних пар у атомів азоту та кисню, що призводить до взаємного відштовхування зв’язуючих та розслабляю-чих електронних пар, які перебувають на гібридизованих орбіталях.
Полярність і поляризованість ковалентного зв’язку.
Якщо молекулу утворено з двох атомів із однаковим значенням електронегативності, то електронна пара або електронні пари зв’язків у однаковій мірі належить обом атомам, тобто електронна хмара розміщу-ється симетрично відносно ядер атомів. Такий ковалентний зв’язок називається гомеополярним або неполярним і молекули з таким типом зв’язку є неполярними. Неполярний зв’язок виявляється у молекул Н2, О2, N2, Cl2, тощо. У молекулах, утворених з двох атомів із різними значення-ми електронегативності, спільну електронну пару або електронні пари зв’язків зсунутого атома з більшою електронегативністю. Утворена при цьому електронна хмара несиметрична. Хімічний зв’язок, у якому електронну пару зсунуто до одного з атомів називається гетерополярним або полярним зв’язком, а відповідні молекули з таким типом зв’язку є полярними. У молекулах із полярним зв’язком атом із більшою електро-негативністю набуває від’ємного заряду, а з меншою – додатного. Напри-клад, у молекулі хлороводню HCl електронну хмару зсунуто в бік атома хлору, у зв’язку з чим середня густина від’ємного заряду біля цього атома більша, ніж біля атома водню. Внаслідок цього в атома хлору виникає деякий надлишковий від’ємний заряд (d –), а в атома водню такий самий за величиною, але протилежний за знаком ефективний додатній заряд (d+). Експериментально встановлено, що ефективний заряд на атомі водню в молекулі HCl dН = + 0,17, а на атомі хлору dCl = – 0,17 абсолют-ного заряду електрона.
При взаємодії двох атомів із досить різними значеннями електроне-гативності електронну пару може бути повністю зсунуто до більш електронегативного атома. Такий зв’язок наближається до йонного.
Отже за ступенем зсуву зв’язуючої електронної хмари зв’язок у молекулі може бути ковалентним неполярним, ковалентним полярним і йонним. Ковалентний неполярний та йонний зв’язки є граничними випад-ками ковалентного полярного зв’язку. Останній є найбільш загальним.
Полярні молекули є диполями, тобто системами, у яких “центри тяжіння” додатних зарядів ядер та від’ємних зарядів електронів на збігаються. Відстань між “центрами тяжіння” у молекулі називають довжиною диполя та позначають літерою l. Полярність молекули (або зв’язку) кількісно характеризується дипольним моментом (m), який у випадку двоатомної молекули дорівнює добуткові довжини диполя на величину заряду електрона: m = l × e.
В одиницях СІ дипольний момент вимірюється у кулон-метрах (Кл ´ ´ м) і є величиною порядку 10-29 Кл × м.
У довідковій літературі дипольний момент часто наводиться у де-баях (Д): 1Д = 3,33 × 10-30 Кл × м. Значення дипольних моментів ковалентних молекул лежить у межах 0 – 4 Д, а йонних: 4 – 11 Д. Чим більша довжина диполя, тим більш полярною є молекула.
Під дією зовнішнього електричного поля електронна хмара у моле-кулі зсувається у бік одного з атомів. Зміна полярності зв’язку молекул під дією електричного поля називається поляризацією, а стан молекули внаслідок поляризації – поляризованістю. Поляризованість молекули залежить від спрямованості електричного поля та поляризованості атомів, що утворюють зв’язки.
Під дією зовнішнього електричного поля неполярні молекули стають полярними, а полярні – ще більш полярними, тобто в молекулах створюється диполь, який називається наведеним або індукованим. На відміну від постійних диполів індуковані існують лише при дії зовніш-нього електричного поля.
ІОННИЙ ЗВ’ЯЗОК
Іонний зв’язок має місце тоді, коли електронегативність елементів різко відрізняється між собою, тобто коли взаємодіють атоми з різко відмінними хімічними властивостями.
Іонний зв’язок слід розглядати як граничний випадок полярного ковалентного зв’язку, коли пара електронів, яка утворює зв’язок, настіль-ки зміщена до одного з атомів, що практично належить цьому атомові. Сполук лише з іонним зв’язком не існує. Однак, у випадках, коли ефек-тивні заряди атомів у сполуках близькі до цілих одиниць, незначний ковалентний характер зв’язку не впливає на їхні властивості й тому такий хімічний зв’язок можна розглядати як іонний. Іонний зв’язок можна пояснити з позиції електростатичної теорії хімічного зв’язку, за якою хімічна взаємодія трактується як процес утворення йонів, які електроста-тично взаємодіють за законом Кулона: 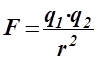 ,
,
де F – сила тяжіння, що діє між різнойменно зарядженими йонами; q1 та q2 – заряди йонів; r – відстань між іонами.
Здатність елементів утворювати прості йони зумовлено електрон-ною будовою атомів. Цю здатність можна оцінити величинами енергій іонізації та спорідненості до електрона. Елементи з малою енергією йоні-зації (лужні та лужноземельні метали) легко утворюють катіони. Прості аніони найлегше утворюють р-елементи VII групи внаслідок великої спорідненості до електрона їхніх атомів. Тому сполуки простих іонів най-легше утворюються при взаємодії лужних або лужноземельних металів із галогенами. Характерною ознакою йонного зв’язку є його не насиченість і ненапрямленість у просторі. Йони можна розглядати як заряджені кульки, силові воля яких рівномірно розподіляються в усіх напрямках у просторі. Так, наприклад, у сполуці NaCl іони натрію можуть взаємодіяти з іонами хлору в будь-якому напрямку, притягуючи певне їх число. Так само і йони хлору можуть взаємодіяти з іонами натрію. Внаслідок нена-прямленості та не насиченості йонного зв’язку енергетично найвигідніше, коли кожен іон оточено максимальним числом іонів протилежного знаку. Інакше кажучи, сполучення між окремими йонами не завершується утво-ренням певних простих молекул, а зумовлює виникнення великих агре-гатів – іонних кристалів, що складаються з великого числа йонів. Число, що показує, скільки протилежно заряджених іонів оточує певний іон у кристалі називається координаційним числом іона. Кількість однаково заряджених іонів, здатних приєднуватись до протилежно зарядженого йо-на, залежить від розмірів іонів і не залежить від електронної будови атомів взаємодіючих елементів. Так, при співвідношенні йонних радіусів у межах 0,41 – 0,73 спостерігається октаедрична координація йонів, а при співвідношенні 0,73 – 1,37 – кубічна координація.
ВОДНЕВИЙ ЗВ’ЯЗОК
Водневий зв’язок пояснюється здатністю атома водню сполученого з атомом сильно електронегативного елемента (F, O, N, у меншій мірі Cl та S), утворювати ще один хімічний зв’язок із електронегативним елементом. Утворення водневого зв’язку зумовлене дуже малим розміром досить поляризованого атома водню у сполуці. При утворенні полярного ковалентного зв’язку між атомами водню та атомами з високою електро-негативністю електронна хмара атома водню сильно зсувається до атома електронегативного елемента. У підсумку атом електронегативного еле-мента набуває значного ефективного від’ємного заряду, а ядро атома вод-ню (протон) майже втрачає електронну хмару. Між протоном водню та від’ємно зарядженим атомом ковалентно-полярної молекули виникає електростатична взаємодія, яка й зумовлює утворення водневого зв’язку. Окрім того, виникнення водневого зв’язку зумовлює також донорно-акцепторна взаємодія, оскільки атом водню має вакантну орбіталь, а атом електронегативного елемента – неподілену електронну пару (чи пари). У графічних формулах водневий зв’язок позначається трьома крапками.
У твердому, рідкому і навіть газоподібному станах молекули фтороводню асоційовані у зигзагоподібні ланцюги:



 F F F
F F F








 H H H H H H
H H H H H H
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 1053; Нарушение авторских прав?; Мы поможем в написании вашей работы!