
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Назви нейтральних комплексних сполук
|
|
|
|
Назву комплексної сполуки починають так само з лігандів, після чо-го йде українська чи латинська назва комплексоутворювача у називному відмінку, закінчується назва валентністю центрального атома. Наприклад:
[Pt(NH3)2Cl4] – тетрахлоро-диамін-платина (IV);
[Fe(CO)5] – пентакарбоніл-залізо (0).
ІЗОМЕРІЯ КОМПЛЕКСНИХ СПОЛУК
У комплексних сполук вирізняють наступні види ізомерії: геометри-чна, оптична, гідратна, іонізаційна та ін.
1) Геометрична ізомерія має місце при різних варіантах просторово-го розташування лігандів у внутрішній сфері. Якщо для координацціного числа 2 існує лише один варіант розташування лігандів – лінійний, то для координацціного числа 4 існує вже два способи симетричної координації:
тетраедр та квадрат.
| Координаційне число | Геометрична конфігурація | ||||||||||
   Лінійна Лінійна
| |||||||||||
 Плоска, квадратна Плоска, квадратна
| |||||||||||
Тетраедрична
| |||||||||||
 Октаедрична Октаедрична
|
Окрім різних геометричних просторових конфігурацій при наявності різних лігандів (у випадку хоча б двох лігандів відмінних від більшості) можлива просторова цис-транс-ізомерія та оптична ізомерія у випадку чо-тирьох різних видів лігандів.
Просторові ізомери відрізняються за кольором, розчинністю, дипо-льним моментом, реакційною здатністю.
2) Гідратна ізомерія має місце при переході води із внутрішньої сфери у зовнішню. Наприклад хлорид гесааквахрому (ІІІ) ізомеризується:
[ Cr(H2O)6]Cl3 ↔ [Cr(H2О)5Cl]Cl2 ∙ Н2О ↔ [Cr(H2О)4Cl2]Cl ∙ 2Н2О
фіолетовий темно-зелений світло-зелений
3) Йонізаційна ізомерія визначається відмінним розподілом іонів між внутрішньою та зовнішньою сферами. Наприклад:
[Cо(NH3)5Br]SO4 ↔ [Cо(NH3)5SO4]Br
сульфат бромо- бромід сульфато-
пентаамін-кобальту (ІІІ) пентаамін-кобальту (ІІІ)
4) Координаційна ізомерія пов’язана з обміном внутрішніми сфера-ми між двома комплексоутворювачами у випадку комплексних аніона та катіона. Наприклад: [Cо(NH3)6][Cr(CN)6] ↔ [Cr(NH3)6][Co(CN)6]
гексациано-(ІІІ)-хромат гексациано-(ІІІ)-кобальтат
гексамін-кобальту (ІІІ) гексамін-хрому (ІІІ)
ДИСОЦІАЦІЯ КОМПЛЕКСНИХ СПОЛУК.
КОНСТАНТИ НЕСТІЙКОСТІ КОМПЛЕКСНИХ ІОНІВ
У розчині комплексні сполуки дисоціюють як сильні електроліти на комплексний іон та йони зовнішньої сфери:
K[Ag(CN)2] ↔ K+ + [Ag(CN)2]-.
Це є рівняння первинної дисоціації комплексної сполуки. Комплексний іон також у певній мірі дисоціює. Це є вторинна дисоціація:
[Ag(CN)2]- ↔ Ag+ + 2CN-.
Для цього оборотнього процесу можна написати константу рівноваги, яка у даному випадку називається константою нестійкості комплексного йону: Кнест = 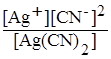 .
.
Чим менше константа нестійкості, тим більш стійкою є комплексна сполука.
Руйнування комплексів
Зруйнувати комплексний іон можна наступними способами: 1) на-гріванням; 2) додаванням реагентів, що дають осад, гази чи слабкі елек-троліти навіть із невеликою кількістю йонів чи молекул, що утворюються при дисоціації комплексного йону (нейтральної сполуки). Наприклад, ко-мплексний іон [Cu(NH3)4]2+ можна зруйнувати додаванням азотної кисло-ти чи сульфіду натрію:
[Cu(NH3)4]2+ + 4HNO3 → Cu2+ + 4NH4+NO3-
[Cu(NH3)4]2+ + Na2S → CuS↓ + 2Na+ + 4NH3
Природа хімічного зв’язку у комплексних сполуках.
У теперішній час для пояснення хімічного зв’язку в комплексних сполуках використовують три теорії – метод валентних зв’язків, метод молекулярних орбіталей і теорію кристалічного поля.
1. Метод валентних зв’язків.
Згідно з цим методом комплексні сполуки утворюються за рахунок донорно-акцепторного зв’язку. Розглянемо на прикладі йону [BF4]-.
BF3 + F- → [BF4]-
Якщо це зобразити схематично для методу валентних зв’язків, то

У йоні [BF4]- спостерігається sp3-гібридизація, тому йон має форму тетра-едра. Таку ж геометричну форму мають комплексні йони Cu2+ та Zn2+. Так у комплексі [Zn(NH3)4]2+ наявний зовнішньоорбітальнийц комплекс, оскі-льки у гібридизації беруть участь лише зовнішні орбіталі – йон цинку надає для електронних пар лігандів одну 4s та три 4р-орбіталі, при цьому відбувається sp3-гібридизація, що відповідає розміщенню лігандів у вершинах тетраедра. Йони d-елементів із чотирма зайнятими d-орбіталя-ми (Pt2+, Pd2+, Au3+) прикоординаціному числі 4 надають для електронних пар лігандів одну (N–1)d, одну Ns та дві Np-орбіталі.
При цьому має місце dsp2-гібридизація, що відповідає розміщенню лігандів у вершинах квадрата. Тому такі комплекси, як [Pt(NH3)4]2+, [PtCl4]2- мають будову плоского квадрата. Координаційному числу 6 від-повідає d2sp3-гібридизація та октаедричне розташування лігандів. Така ко-ординація має місце, наприклад, у комплексах платини (IV), наприклад у
[Pt(NH3)6]4+.
Якщо у гібридизації беруть участь d-орбіталі передостаннього рівня, тоді йон називається внутрішьоорбітальним. Іноді у комплексах проявля-ється йонно-дипольний зв’язок, наприклад в аква-комплексах.
Л І Т Е Р А Т У Р А
1. Н.С.Ахметов – Общая и неорганическая химия. М: Высшая школа, 1998 – 640 с.
2. А.М.Бутенко, В.І.Булавін, Т.П.Ярошок та ін. – Загальна хімія. К: Вища школа, 1997 – 392 с.
3. В.В.Григор’єва, В.М.Самійленко, А.М.Сич, – Загальна хімія. К: Вища школа, 1991 – 431 с.
4. И.А.Зубович – Неорганическая химия. М: Высшая шк., 1989 – 423 с.
5. М.Х.Карапетьянц, С.И.Дракин – Общая и неорганическая химия. М: Химия, 1981 – 632 с.
6. Н.В.Коровин – Общая химия М: Высшая школа, 1998 – 559 с.
7. М.И.Мартыненко, В.И.Спицын – Избранные главы неорганической химии. М: Издательство МГУ, 1986 – 287 с.
8. Неорганическая химия Дж.Хьюи. Строение вещества и реакционная способность. М: Химия, 1987 – 696 с.
9. Общая химия. (под ред. Е.М.Соколовской и Л.С.Гузея) М: Издательство МГУ, 1989 – 640 с.
10. Общая химия. Биофизическая химия. Химия биогенных елементов. (под ред. Ю.А.Ершова) М: Высшая школа, 2000 – 560 с.
11. Э.Н.Рэмсден – Начала современной химии. Ленинград: Химия, 1989 – 784 с.
12. Б.Д.Степин, А.А.Цветков – Неорганическая химия. М: Высшая школа, 1994 – 608 с.
13. А.В.Суворов, А.Б.Никольский – Общая химия. СПБ: Химия, 1997 – 624 с.
14. Я.А.Угай – Общая и неорганическая химия. М: Высшая школа, 1997 – 527 с.
З М І С Т
Тема 1. Основні поняття та закони хімії................................................... 4
Тема 2. Основні класи неорганічних сполук................................................. 8
Тема 3. Будова атома та періодична система елементів....................... 13
Тема 4. Хімічний зв’язок і будова молекул.................................................. 23
Тема 5. Основи хімічної термодинаміки.................................................... 34
Тема 6. Хімічна кінетика. Хімічна рівновага. Каталіз............................. 54
Тема 7. Розчини............................................................................................. 77
Тема 8. Комплексні сполуки........................................................................ 90
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 618; Нарушение авторских прав?; Мы поможем в написании вашей работы!


