
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислоти
|
|
|
|
Кислоти – це складні речовини, молекули яких у водних розчинах дисоціюють з утворенням катіонів водню та аніонів кислотних залишків:
НСl «H+ + Cl-;
Н3PO4 «H+ + H2PO4-;
H2PO4- «H+ + HPO42-;
HPO42- «H+ + PO43-.
Кислоти класифікують за складом на
безкисневі: HF, HCl, HI, H2S, H2Se, HCN, HSCN, H[AuCl4], H2[SiF6], тощо
та кисневмісні: H3BO3, H3PO4, H2SO4, HMnO4, HNO3, HBrO3, тощо,
а також за здатністю дисоціювати у водних розчинах на
сильні: HCl, H2SO4, HNO3, HClO4, HMnO4, H2[SiF6], тощо,
середньої сили: H3PO4, H2SO3, HNO2, HF, тощо
та слабкі: H3BO3, H2СO3, H2SiO3, H2S, HCN, HClO, H2MoO4, тощо.
Способи одержання кислот
1. Дія більш сильної, більш стійкої та менш леткої кислоти на сіль більш слабкої, менш стійкої та більш леткої кислоти:
Na2SiO3 + H2CО3 ® Na2CO3 + H2SiО3¯;
Na2SO3 + 2HCl ® 2NaCl + H2SО3;
2NaCl + H2SО4(конц.) ® Na2SO4 + 2HCl.
2. Безкисневі кислоти, взаємодією неметалів з воднем:
Cl2 + Н2 ® 2HCl; S + Н2 ® H2S;
3. Кисневмісні кислоти, взаємодією кислотних оксидів із водою:
SО3 + Н2O ® H2SO4; P2О5 + 3Н2O ® 2H3PO4;
CrО3 + Н2O ® H2CrO4; B2O3 + 3Н2O ® 2H3BO3.
Хімічні властивості кислот
Загальною властивістю кислот є їхня взаємодія з гідроксидами металів та амонію. Ця взаємодія називається реакцією нейтралізації:
HCl + NaOH ® NaCl + H2O;
2HNO3 + Cu(OH)2 ® Cu(NO3)2 + 2H2O;
H3PO4 + 3NH4OH ® (NH4)3PO4 + 3H2O.
Кислоти легко реагують з оксидами металів (основними та амфотерними) також з утворенням солей і води:
СaO + 2HNO3 ® Ca(NO3)2 + 2H2O;
Al2O3 + 6HCl ® 2AlCl3 + 3H2O.
Кислоти реагують також із солями з утворенням інших солей та кислот: Са3(PО4)2 + 3H2SO4 ® 3CaSO4 + 2H3PO4;
FeS + 2HCl ® FeCl2 + H2S;
2Al(OH)3 – to ® Al2O3 + 3H2O.
З металами кислоти реагують по різному, в залежності від активно-сті металу, хімічної природи кислоти, концентрації розчину та деяких інших чинників:
1. Розведені водорозчинні кислоти, що не мають окисних властиво-стей реагують із активними металами, розташованими у ряду стандартних електродних потенціалів до водню з утворенням солі та газоподібного водню: Fе + H2SO4(розв.) ® FеSO4 + H2;
Zn + 2HCl(розв.) ® ZnCl2 + H2.
Метали, розташовані у ряду стандартних електродних потенціалів після водню (Bi, Cu, Au, Hg, тощо), не витісняють водень із кислот. Ані один із металів не витісняє водень із азотної та концентрованих сірчаної та хлорної кислот.
2. Водорозчинні кислоти, що проявляють сильні окисні властивості (HNO3, концентровані H2SO4, HClO4) взаємодіють із великою кількістю металів з утворенням солі металу, води та продукту відновлення кислото-утворюючого елемента. Продукти відновлення у значній мірі залежать від концентрації кислоти та активності металу.
Наприклад малоактивний метал – мідь взаємодіє з цими кислотами:
Cu + 2H2SO4(конц.) ® CuSO4 + SO2 + 2H2O;
Cu + 4HNO3(конц.) ® Cu(NO3)2 + 2NO2 + 2H2O;
3Cu + 8HNO3(розв.) ® 3Cu(NO3)2 + 2NO + 4H2O.
А дуже активний метал – кальцій взаємодіє з азотною кислотою:
4Ca + 10HNO3(конц.) ® 4Ca(NO3)2 + N2O + 5H2O;
5Ca + 12HNO3(pозв.) ® 5Ca(NO3)2 + N2 + 6H2O;
4Ca + 10HNO3(дуже розв.) ® 4Ca(NO3)2 + NH4NO3 + 3H2O.
Солі
Солі – це складні речовини, у молекулах яких катіони металів або амонію пов’язані з аніонами кислотних залишків.
Розрізняють солі:
cередні – NaСl, K2SO4, (NH4)2Cr2O7,;
кислі (гідро-) – NaНCO3, CaHPO4, Ba(HS)2, тощо;
основні (гідроксо-) – Сa(OH)Cl, (MgOH)2SO4, Al(OH)2NO3, тощо та
комплексні – Na3[Al(OH)6], K4[Fe(CN)6], [Cr(H2O)4Cl2]Cl, тощо.
Основні способи одержання солей
1. Взаємодія кислот з гідроксидами:
2HCl + Fe(OH)2 ® FeCl2 + 2H2O;
2Cu(OH)2 + H2SO4 ® (CuOH)SO4 + 2H2O.
NaOH + H3PO4 ® 2NaH2PО4 + H2O;
2. Взаємодія кислот з оксидами металів:
BaO + 2НBr ® BaBr2 + H2O; Al2O3 + 6НNO3 ® 2Al(NO3)3 + 3H2O;
3. Взаємодія кислот із солями:
AgNО3 + НCl ® AgCl¯ + HNО3; CaCО3¯ + Н2CO3 ® Ca(HCO3)2.
4. Взаємодія металу з неметалом – деякі солі безкисневих кислот:
2Fe + 3Cl2 ® 2FeCl3; Hg + S ® HgS.
5. Взаємодія металу з кислотою:
2Fe + Н2SO4 ® 2FeSO4 + H2; Ag + 2HNO3 ® AgNO3 + NO2 + H2O.
6. Взаємодія амфотерного металу з лугом:
Zn + 2NaOH – to ® Na2ZnO2 + H2O.
7. Взаємодія металу з розчином солі менш активного металу:
Fe + CuSO4 ® FeSO4 + Cu.
8. Взаємодія основного оксиду з кислотним:
CaО + SiO2 ® CaSiO3; Na2O + P2O5 ® 2NaPO3.
9. Взаємодія двох розчинних солей:
BaCl2 + Na2SO4 ® BaSO4¯ + 2NaCl;
2AgNO3 + CuCl2 ® 2AgCl¯ + Cu(NO3)2.
10. Взаємодія гідроксиду металу (амонію) з кислотним оксидом:
2KОH + CO2 ® K2CO3 + H2O; 2NH4OH + CrO3 ® (NH4)2CrO4 + H2O.
Тема 3. БУДОВА АТОМА ТА ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ
1. КВАНТОВА ТЕОРІЯ СВІТЛА
У 1900 році німецький фізик М. Планк, вивчаючи природу випромі-нювання нагрітих тіл, висловив припущення, що енергія випромінюється та поглинається не безперервно, а дискретно, певними порціями – кванта-ми, енергія яких пропорційна частоті коливань. Тобто перехід від одного енергетичного стану атома чи молекули до найближчого іншого супрово-джується випромінюванням або поглинанням енергії у вигляді певних порцій – квантів енергії. Величину кванта енергії можна обчислити із співвідношення, яке називається рівнянням Планка:
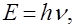
де Е – кількість енергії з частотою коливань n,
а h – універсальна стала Планка, що дорівнює 6,626 × 10-34 Дж × с.
Постулат Планка було обґрунтовано Альбертом Айнштайном (Ейн-штейном) у 1905 році. Аналізуючи явище фотоелектричного ефекту, тоб-то здатність певних елементів приводити до руху електрони під дією світла, він дійшов до висновку, що електромагнітна (промениста) енергія існує лише у формі квантів, і випромінювання є потоком неподільних матеріальних “частинок” – фотонів, енергія яких визначається за рівнян-ням Планка.
2. КОРПУСКУЛЯРНО-ХВИЛЬОВА ПРИРОДА ЕЛЕКТРОНА
У 20-х роках ХХ століття завдяки роботам де-Бройля, Е. Шрьодин-гера, В. Гайзенберга було розроблено основи хвильової теорії мікрочасти-нок та поєднано їх із теорією про корпускулярно-хвильову природу світ-лового випромінювання.
З рівнянь Планка Е = hn та Айнштайна Е = mc2 випливає, що hn= = mc2. Враховуючи, що n = c/l та швидкість руху фотона v = швидкості світла c, дістанемо основне рівняння хвильової механіки – рівняння де-Бройля:  .
.
З цього рівняння випливає, що частинці з масою m, яка рухається зі швидкістю v, відповідає хвиля з довжиною l. Рівняння можна використо-вувати для характеристики руху не лише фотона, а й інших матеріальних мікрочастинок: електрона, нейтрона, протона та інших. Отже те, що елек-трони мають подвійну корпускулярно-хвильову природу й відіграють ви-рішальну роль у хімічних взаємодіях зумовило появу такої дисципліни як квантова хімія.
3. ПРИНЦИП НЕВИЗНАЧЕНОСТІ. ЕЛЕКТРОННІ ХМАРИ
У 1925 році Гайзенберг запропонував принцип невизначеності, згід-но з яким не можна одночасно визначити точне місце перебування елек-трона у просторі та напрямок його руху або імпульсу. З цього випливає, що електрон може перебувати у будь-якій частині простору, навколо атома, однак імовірність його перебування у тій чи іншій частині цього простору неоднакова.
Рух електрона має хвильовий характер, тому квантова механіка описує цей рух за допомогою хвильової функції Y, яка набуває різних значень у різних точках навколоатомного простору. Квадрат хвильової функції Y 2 виражає ймовірність перебування електрона у певній точці навколоатомного простору, а величина Y 2dV ймовірність перебування електрона в елементі об’єму dV. Як модель стану електрона в атомі у квантовій механіці прийнято уявлення про електронну хмару, густина окремих ділянок якої пропорційна ймовірності перебування там елек-трона.
Простір навколо ядра, у якому перебування електрона є найбільш імовірним називається орбіталлю.
4. КВАНТОВІ ЧИСЛА
Згідно з квантово-механічною теорією стан електрона в атомі харак-теризується значеннями чотирьох квантових чисел: n – головного; l – орбітального; ml – магнітного; ms – спінового.
Головне квантове число n – визначає радіус квантового рівня (се-редню віддаль від ядра до ділянок підвищеної електронної густини) або загальну енергію електрона на певному рівні: Е = – 13, 6/n2 (еВ).
Головне квантове число може набувати додатних цілочислових зна-чень: 1; 2; 3...¥. Квантовий стан атома із найменшою енергією електрона називається основним (n = 1, E1 = – 13,6 eB). Квантовий стан атома з більшими значеннями енергії (E2 = – 3,4 eB, E3 = – 1,5 eB,..., E¥ = 0 еВ). Електрон в основному стані зв’язаний із ядром найміцніше, у збудженому стані зв’язок із ядром послаблюється. Стан електрона, який характеризу-ється певним значенням головного квантового числа називають енерге-тичним рівнем електрона в атомі. Для енергетичних рівнів електрона в атомі, що відповідають різним значенням n, прийнято позначення великим латинськими літерами: n – 1 2 3 4 5 6 7
|
|
|
|
|
Дата добавления: 2013-12-13; Просмотров: 556; Нарушение авторских прав?; Мы поможем в написании вашей работы!