
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція №7. Хімічна кінетика
|
|
|
|
НF → HCl → HBr → HI
 зменшується термічна стійкість
зменшується термічна стійкість
| ∆Н0утв.НF = -268,6кДж/моль | ∆Н0утв.НBr = -35,9кДж/моль | |
| ∆Н0утв.НСІ = -92,3кДж/моль | ∆Н0утв.НІ = +25,9кДж/моль |
ІІ. Закон Гесса, або закон постійності сум тепла (1840): ентальпія реакції залежить лише від початкового та кінцевого станів реагентів і не залежить від шляху перебігу, тобто від числа й характеру проміжних стадій.
Значення закону Гесса: дозволяє обчислити теплоти утворення нестабільних сполук і теплові ефекти хімічних реакцій, які не можна здійснити експериментально.
Наслідки із закону Гесса:
þ Ентальпія утворення не залежить від способу одержання сполуки;
þ Ентальпія реакції (тепловий ефект реакції) дорівнює різниці між сумою ентальпій утворення продуктів реакції та сумою ентальпій утвореннявихідних речовин (реагентів) з урахуванням стехіометричних кількостей речовин.
Рівняння хімічної реакції: а А + в В → с С + d D
А, В – вихідні речовини (реагенти);
С, D – продукти реакції (кінцеві речовини);
a, в, c, d – стехіометричні коефіцієнти.
Математичний вираз наслідку із закону Гесса:
∆Н0 = с∙ΔН0утв.С + d ∙∆Н0утв.D – (а ∙∆Н0утв.А + в ∙ΔН0утв.В)
Основні питання:
1. Хімічна кінетика.
2. Швидкість хімічних реакцій.
3. Залежність швидкості реакції від:
a. концентрації реагуючих речовин (закон діючих мас);
b. температури (правило Вант-Гоффа, рівняння Ареніуса, теорія зіткнення, теорія перехідного стану).
c. наявності каталізатора.
4. Кінетика процесів випікання та сушіння харчових продуктів у виробництві харчової продукції.
5. Фотохімічні та ланцюгові реакції.
Розділ хімії, що розглядає швидкість і механізм хімічних реакцій, називають хімічною кінетикою.
Швидкість хімічної реакції – це число елементарних актів взаємодії за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці поверхні поділу фаз (для гетерогенних реакцій).
Швидкість реакції визначається зміною концентрації будь-якої з вихідних речовин або кінцевих продуктів.
υ = 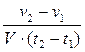 або υ =
або υ = 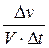 ,
,
де ∆ v - зміна кількості речовини, моль
∆t – зміна часу, сек.
V – об’єм, см3 або л
Одиниці вимірювання швидкості реакції: моль/(л∙сек), або моль/(м3∙сек).
Якщо V = 1л, то v = С (молярна концентрація – число молей речовини в 1л розчину), тобто υ =  , де
, де
υ – середня швидкість реакції у даний проміжок часу в ізобарно-ізотермічних умовах.
Істинна швидкість реакції виражається першою похідною від концентрації за часом. Дорівнює тангенсу кута нахилу дотичної до кривої залежності концентрації від часу: υ = tgα
Для складних реакцій: швидкість реакції, яка складається з кількох елементарних стадій, визначається швидкістю перебігу найповільнішої з них.
Експериментально швидкість реакції можна знайти, визначаючи концентрацію однієї з речовин у різний момент часу.
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 506; Нарушение авторских прав?; Мы поможем в написании вашей работы!