
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вплив температури на швидкість реакції
|
|
|
|
Визначається правилом Вант-Гоффа (1884): з підвищенням температури на кожні 100 швидкість гомогенних реакцій зростає в 2 – 4 рази.
υ2 = υ1 ∙ γ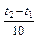 ,
,
де υ1 – швидкість реакції при температурі t1;
υ2 – швидкість реакції при температурі t2;
γ – температурний коефіцієнт реакції (показує, у скільки разів зростає швидкість реакції зі збільшенням температури на кожні 100).
Правило Вант-Гоффа справедливе для інтервалу температур: 273-373К.
Основні положення теорії зіткнень:
1. Молекули газу повинні зіткнутися, щоб прореагувати.
2. Швидкість реакції менша, частоти зіткнень.
3. Під час реакції у взаємодію вступають тільки активні молекули (мають деякий надлишок енергії порівняно з середньою енергією при даній температурі).
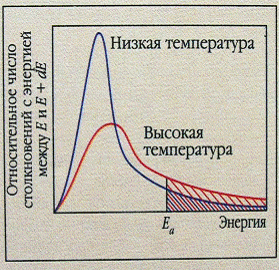
| 4. З підвищенням температури число активних частинок різко зростає. Nакт = N0 ∙ е-Еа/RT, де Nакт – число активних молекул; N0– загальне число молекул; Nакт < N0; Еа– енергія активації. Енергія активації –це надлишкова енергія порівняно з середньою енергією реагуючих речовин, яку повинні мати молекули, щоб їх зіткнення призводили до хімічної взаємодії. При підвищенні температури частка молекул, енергія яких перевищує значення енергії активації, швидко збільшується. | 
|
5. При хімічній реакції число активних молекул зменшується, проте в результаті перерозподілу енергії частка Nакт / N0 відновлюється.
З підвищенням Т зростає Nакт, збільшується кількість ефективних зіткнень (А акт.), що призводить до збільшення швидкості реакції υ.
| Еа = 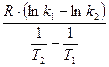 Енергія активації для більшості процесів змінюється у межах від 50 до 250кДж/моль.
Якщо Еа < 40кДж/моль, то реакція відбувається миттєво, якщо Еа = 40 ‑ 120 кДж/моль, то реакція перебігає з певною швидкістю, яку можна виміряти; при Еа > 120кДж/моль швидкість реакції дуже мала.
Енергія активації може бути знижена під впливом зовнішніх факторів: збільшення температури, променистої енергії, каталізаторів.
Енергія активації для більшості процесів змінюється у межах від 50 до 250кДж/моль.
Якщо Еа < 40кДж/моль, то реакція відбувається миттєво, якщо Еа = 40 ‑ 120 кДж/моль, то реакція перебігає з певною швидкістю, яку можна виміряти; при Еа > 120кДж/моль швидкість реакції дуже мала.
Енергія активації може бути знижена під впливом зовнішніх факторів: збільшення температури, променистої енергії, каталізаторів.
| 
|
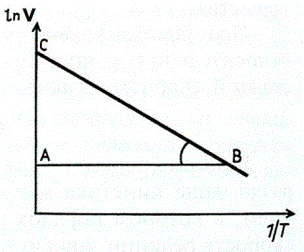
| При підвищенні температури частка молекул, енергія яких перевищує значення енергії активації, швидко збільшується. | Графік для визначення енергії активації |
6. Під час зіткнення частинки повинні бути певним чином орієнтовані.
Аакт = А0 ∙ е-Еа/RT,
де А0 – загальне число зіткнень;
Аакт – частота співударів молекул, орієнтованих певним чином (активних).
7. Число зіткнень активних молекул визначає швидкість реакції.
υ0 = κ0, κ = κ0 ∙ е-Еа/RT
ln κ = ln κ0 -  , ln κ0 = ln A
, ln κ0 = ln A
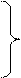 ln∙κ = lnA-
ln∙κ = lnA-  рівняння Арреніуса
рівняння Арреніуса
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 736; Нарушение авторских прав?; Мы поможем в написании вашей работы!