
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зміна швидкості реакції в часі
|
|
|
|
для реагентів для продуктів
 С C1 > C2 С C1 > C2
υ =
t1 t2 t Під час реакції концентрації (реагентів) зменшуються, що призводить до зменшення її швидкості |  С C1 < C2 С C1 < C2
   С2 υ = С2 υ =  С1
С1
t1 t2 t Під час реакції концентрації продуктів збільшуються, що призводить до зростання її швидкості. |

Швидкість реакції залежить від:
þ природи реагуючих речовин;
þ доступності реагентів (ступінь подрібнення твердих реагентів, площа поверхні стикання реагентів);
þ концентрації реагентів;
þ температури;
þ наявності каталізатора.
Залежність швидкості реакції від концентрації реагентів
Визначається законом діючих мас (Гульдберг і Вааге, 1867) – основним законом хімічної кінетики.
Формулювання закону діючих мас: швидкість хімічної реакції пропорційна добуткові концентрацій реагентів.
У загальному випадку для реакції: аА + bВ ↔ сС + dD швидкість реакції дорівнює
υ = κ∙САа ∙ СВb, (кінетичне рівняння гомогенної реакції), де
СА і СВ – концентрації реагентів;
а, b – коефіцієнти в рівнянні реакції;
κ – константа швидкості реакції (швидкість реакції при концентраціях реагентів 1моль/л), характеризує здатність реагентів до взаємодії; характеризує дану реакцію за постійної тмператури.
| κ залежить від: • природи реагентів; • температури; • наявності каталізаторів. | κ не залежить від: • концентрацій речовин; • часу. |
Реакції, що відбуваються за однакових умов, порівнюють за їх константами швидкостей.
Закон діючих мас справедливий для:
ü простих реакцій;
ü ідеальних газів;
ü розведених розчинів.
Швидкість гетерогенних реакцій залежить від:
S концентрації рідкої або газоподібної речовини;
S величини поверхні S твердих реагентів (збільшення S↑ призводить до υ↑, досягається подрібненням);
S дифузії (надходження до поверхні твердого реагенту нових порцій реагуючих речовин) – прискорюють струшуванням і перемішуванням.
Молекулярність реакції – число молекул, які беруть участь в елементарному акті взаємодії. Виражається цілим числом, Реакції: мономолекулярні, димолекулярні, тримолекулярні. Одночасне зіткнення в одній точці чотирьох і більше частинок малоймовірне. Молекулярність реакції – поняття теоретичне.
Порядок реакції – сума показників степенів при концентраціях у кінетичному рівнянні реакції. Може змінюватися зі зміною температури та тиску. Для елементарних реакцій збігається з молекулярністю. Для складних реакцій ‑ може бути дробовим, нульовим і навіть від’ємним.
Фактори, які спричиняють різницю між молекулярністю і порядком реакції:
¦ сталість концентрації одного з компонентів реакції в реакційні й суміші;
¦ складана реакція, яка відбувається в декілька стадій, молекулярність і швидкість яких різна;
¦ каталітичні реакції зі складним механізмом, який не відображається стехіометричним рівнянням.
Порядок реакції – експериментальна величина. Визначають за виглядом рівняння, яке відображає експериментальну залежність швидкості даної реакції від концентрації реагуючих речовин.
| Тип реакції | Рівняння хімічної реакції | Кінетичне рівняння | Примітка |
| Реакція нульового порядку: | 2NH3 → N2 + 3H2 (у присутності вольфраму) | υ = k∙c0 | Швидкість не залежить від концентрації реагента (гетерогенні реакції, ферментативні процеси) |
| Реакції першого порядку: | С12Н22О11 + Н2О → 2С6Н12О6 | υ = κ ∙С (С12Н22О11) | Реакції ізомерного перетворення, гідролізу |
| СН3СОСН3 → СО2 + С2Н4 + Н2О | υ = κ ∙С (СН3СОСН3) | ||
| Реакції другого порядку: | 2Н2О2 → 2Н2О + О2 | υ = κ ∙ С2 (Н2О2) | |
| 2NO → N2О2 | υ = κ ∙ С2 (NO) | ||
| Н2 + І2 → 2НІ | υ = κ ∙ С(Н2) ∙ С(І2) | ||
| Реакції третього порядку: | СІ2 + 2NO → 2NOCІ | υ = κ ∙ С(СІ2)∙С2(NO) | |
| Для гетерогенних реакцій: | С(тв) + О2 → СО2 | υ = κ ∙ С(О2) | Реакція першого порядку |
|
|
|
|
|
Дата добавления: 2013-12-14; Просмотров: 718; Нарушение авторских прав?; Мы поможем в написании вашей работы!

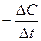

 C1
C1
 С2
С2
