
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Семейство платины
|
|
|
|
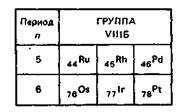 В подгруппу платины входит шесть переходных металлов. По числу электронов на 4dЗs-орбиталях (Ru, Rh, Рd) и 5d6s-орбиталях (Оs, Ir, Рt) и по аналогии физико-химических свойств все элементы VI IIБ-группы делятся на три подгруппы: 1) Ru — Оs; 2) Rh — Ir; 3) Рd — Рt. Атомный радиус у всех шести элементов изменяется в небольшом интервале: 134 пм (Ru) — 139 пм (Рt).
В подгруппу платины входит шесть переходных металлов. По числу электронов на 4dЗs-орбиталях (Ru, Rh, Рd) и 5d6s-орбиталях (Оs, Ir, Рt) и по аналогии физико-химических свойств все элементы VI IIБ-группы делятся на три подгруппы: 1) Ru — Оs; 2) Rh — Ir; 3) Рd — Рt. Атомный радиус у всех шести элементов изменяется в небольшом интервале: 134 пм (Ru) — 139 пм (Рt).
В электрохимическом ряду все платиновые металлы стоят после водорода. По значениям электроотрицательности все элементы группы ближе к неметаллам, чем к металлам. Поэтому соединения этих металлов проявляют амфотерность, выраженную в разной степени. Гидроксиды не всех этих элементов растворяются и в кислоте и в щелочи. Тем не менее, элементы семейства платины образуют не только катионные, но и анионные комплексы. Устойчивые валентные состояния для элементов семейства платины следующие: Ru — IV, VI, VIII; Rh — III, IV; Рd — II, IV; Оs — IV, VI; Ir — III, IV; Рt — II, IV.
Гидроксиды Ru, Rh, Рd, Оs, Ir и Рt в четырехвалентном состоянии существуют в форме МО2∙nН2О, где n = 2 (для платины n = 2, 3). Содержание воды зависит от температуры.
Гидроксиды Rh, Рd и Рt растворяются в кислотах и щелочах:
РtO2∙3Н2О + 2NаОН → Na2[Рt(ОН)6] + Н2О
РtO2∙3Н2О + 6НСl → H2[РtСl6] + 5Н2О
В обычных условиях платиновые металлы не взаимодействуют с такими сильными окислителями, как F2, Сl2 и О2. Низкая реакционная способность элементных веществ определяется большой энергией связи в кристаллической решетке. Та же причина определяет высокие температуры плавления и большие значения плотности.
Только платина реагирует без нагревания с окисляющей смесью кислот
3Рt + 18НСl + 4НNО3 ⇄ 3H2[PtСl6] + 4NО + 8Н2О
или с соляной кислотой в присутствии кислорода
Рt + 6НСl + О2 ⇄ Н2[РtСl6] + 2Н2О
Все металлы платинового семейства, кроме иридия, переходят в четырехвалентное состояние при сплавлении со щелочными окисляющими смесями. Например:
Ru + 2КОН + 3КNО3 → К2RuО4 + 3КNО2 + Н2О
Иридий переходит в трехвалентную форму.
При нагревании платиновые металлы реагируют с NаСl или НСl в токе хлора, что приводит к образованию комплекса. Например:
Ir + 2NаСl + 2Сl2 → Na2[IrСl6]
Платина при нагревании может образовывать цианидный комплекс:
Рt + 6КСN + 4Н2О → К2[Рt(СN)6] + 4КОН + 2Н2
Элементы платинового семейства образуют комплексные соединения с координационными числами 4 и 6. Наиболее изучены цианидные, галогенидные и аммиачные комплексы. Комплексные соединения могут быть катионные, анионные и нейтральные. Катионный комплекс:
[Рt(NН3)2Сl2] + 2NН3 → [Рt(NН3)4Сl2]
Нейтральный комплекс:
[Рt(NН3)4]Сl2 + 2НСl ⇄ [Рt(NН3)2Сl2] + 2NН4Сl
Катионно-анионный комплекс:
[Рt(NН3)4]Сl2 + К2[РtСl4] → [Рt(NН3)4] [РtСl4] + 2КСl
Применение соединений платиновых элементов в медицине. Многочисленные исследования показали, что цис-изомер дихлородиамминплатины(II) [Рt(NН3)4]Сl2 оказывает лечебное действие при раковых заболеваниях. Действие этого комплекса основано на том, что в нем происходит постепенное замещение хлорид-ионов хелатирующими лигандами. Такими лигандами являются аминокислотные остатки в белках. Координация идет за счет взаимодействия металла с атомами азота лиганда. После замещения хлорид-ионов создаются условия для замещения и групп NН3. В результате платина образует четыре связи с новыми лигандами. Это свойство цис-дихлородиамминплатины приводит к образованию устойчивого комплекса с молекулой ДНК. Таким образом, это вещество ингибирует синтез ДНК. Интересно отметить, что транс-изомер дихлородиамминплатины (II) токсичен, но противоопухолевым действием не обладает.
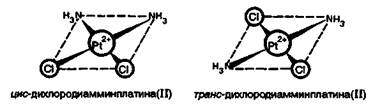 Наряду с цис-дихлор-диамминплатиной (II) противоопухолевой активностью обладают и другие комплексы, содержащие в качестве лигандов амины и хлорид-ионы. Например, цыс-диамминтетрахлорплатина (IV) [Рt(NН3)2Сl4] и цис-дианилиндихлороплатина (II) [Pt(NH2C6H5)2Cl2]:
Наряду с цис-дихлор-диамминплатиной (II) противоопухолевой активностью обладают и другие комплексы, содержащие в качестве лигандов амины и хлорид-ионы. Например, цыс-диамминтетрахлорплатина (IV) [Рt(NН3)2Сl4] и цис-дианилиндихлороплатина (II) [Pt(NH2C6H5)2Cl2]:
 Сплавы Рt — Ir и Рt — Аu применяются в ортопедической стоматологии, для изготовления шприцов; сплавы Рd—Аu, Рd—Аu—Рt, Рd—Рt—Ir — для изготовления хирургических инструментов, в ортопедической стоматологии используют сплавы Рd—Аu или Рd—Аg,Сu,Ir. Вживляемые в сердце электроды для стимуляции изготовлены из сплава Рt—Ir; Ir—Рt — эталон массы (а раньше и длины). Для дезинфекции питьевой воды применяют О3, его можно получить по реакции:
Сплавы Рt — Ir и Рt — Аu применяются в ортопедической стоматологии, для изготовления шприцов; сплавы Рd—Аu, Рd—Аu—Рt, Рd—Рt—Ir — для изготовления хирургических инструментов, в ортопедической стоматологии используют сплавы Рd—Аu или Рd—Аg,Сu,Ir. Вживляемые в сердце электроды для стимуляции изготовлены из сплава Рt—Ir; Ir—Рt — эталон массы (а раньше и длины). Для дезинфекции питьевой воды применяют О3, его можно получить по реакции:
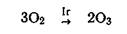 , где Ir — катализатор (порошкообразный иридий).
, где Ir — катализатор (порошкообразный иридий).
Оксид осмия (VIII) ОsO4 применяется как фиксатор ткани (липидный стабилизатор) для гистологических исследований в виде 1%-ного раствора в ацетоне. ОsO4 можно использовать и для электронно-микроскопического выявления ферментов. Механизм действия ОsO4 может быть представлен в следующем виде:
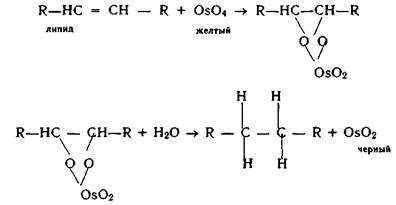
Восстановление может идти глубже и будет образовываться Оs2О3 или ОsО. Все эти соединения имеют темно-коричневый или черный цвет, т.е. обеспечивается эффект контрастирования участка клетки или ткани (образуются эфиры холестерина и триглицеридов)
Комплекс [Ru(NН3)4(ОН)Сl]Сl — рутениевый красный также применят для анатомических и гистологических исследований. Его раствор (1:5000) окрашивает в розово-красные тона пектин.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1513; Нарушение авторских прав?; Мы поможем в написании вашей работы!