
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные законы
|
|
|
|
Основные понятия
Химия относитсяк числу естественных наук и изучает вещества, их состав, строение, свойства и превращения. Объектом изучения в химии являются химические элементы и их соединения.
Химический элемент – это вид атомов с одинаковым зарядом ядер. Атом – наименьшая частица химического элемента, сохраняющая все химические свойства данного элемента. Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая всеми химическими свойствами данного вещества и состоящая из одинаковых или различных атомов. Если молекула состоят из одинаковых атомов, то вещество называют простым, например О2, Н2, N2, Cl2. Если молекула вещества состоит из атомов разных элементов, то вещество называется сложным, напримерCO, H2O, NH3, H3PO4.
Единицей измерения количества вещества является моль. М оль – это количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов и др.) данного вещества, сколько атомов содержится в 12 г изотопа углерода 12С. Вычислено, что в 12 г 12С содержится 6,02·1023 атомов. Это число называется числом Авогадро и обозначается NА. Следовательно, в одном моле любого вещества содержится 6,02·1023 частиц. Масса одного моля вещества называется молярной массой вещества и обозначается М. Молярную массу обычно выражают в г/моль и численно она равна относительной молекулярной массе. Например, М(Н2SO4) = 98 г/моль.
Эквивалент (Э) – это реальная или условная частица вещества, соответствующая одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент так же, как атом, молекула, ион – безразмерная величина, и его состав выражают с помощью химических формул и символов. Например, эквивалентом гидроксида калия и соляной кислоты будут соответственно KOH и HCl, серной кислоты – 1/2 H2SO4, хлорида алюминия – 1/3 AlCl3. Количество вещества эквивалентов измеряется в молях. Масса 1 моль эквивалентов называется молярной массой эквивалентов (Мэк) и выражается в г/моль.
Закон сохранения массы и энергии: в изолированной системе сумма масс и энергий постоянна. Между массой m и энергией E существует взаимосвязь: E = mc2, где с – скорость света в вакууме.
Закон Авогадро: в равных объемах различных газов при одинаковых условиях (давлении и температуре) содержится одинаковое число молекул
(6,02·1023). Из закона Авогадро следует, что моль любого газа при нормальных условиях (р0 = 101,325 кПа, Т0 = 273 К) занимает объем 22,4 л (молярный объем).
Закон эквивалентов: массы реагирующих друг с другом веществ прямо пропорциональны молярным массам их эквивалентов:
 .
.
Из закона эквивалентов следует, что число молей эквивалентов веществ, участвующих в реакции, равны между собой.
Классы неорганических соединений
Все вещества делятся на простые и сложные. Сложные вещества подразделяются на четыре важнейших класса: оксиды, кислоты, основания, соли.
Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
Оксиды разделяются на несолеобразующие (N2O, NO, SiO) и солеобразующие. Солеобразующие оксиды по химическим свойствам делятся на основные (Na2O, CaO, MgO, CuO, MnO), кислотные (CO2, SO3, P2O5, CrO3, Mn2O7) и амфотерные (ZnO, BeO, Al2O3, Cr2O3, PbO, SnO).
1. Основные оксиды щелочных и щелочноземельных металлов взаимодействуют с водой, образуя растворимые в воде основания - щелочи:
Na2O + H2O = 2NaOH;
CaO + H2O = Ca(OH)2.
Кислотные оксиды, взаимодействуя с водой, образуют кислоты:
N2O5 + H2O = 2HNO3;
SO3 + H2O = H2SO4.
2. Основные оксиды взаимодействуют с кислотами с образованием соли и воды:
CaO + 2HCl = CaCl2 + H2O;
MgO + 2HNO3 = Mg(NO3)2 + H2O.
Кислотные оксиды взаимодействуют с основаниями с образованием соли и воды:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O;
SO3 + 2KOH = K2SO4 + H2O.
Амфотерные оксиды взаимодействуют с кислотами как основные и с основаниями как кислотные:
ZnO(основной оксид) + 2HCl = ZnCl2 + H2O;
ZnO(кислотный оксид) + 2KOH = K2ZnO2 + H2O.
3. При взаимодействии основных и кислотных оксидов образуются соли: Na2O + CO2 = Na2CO3.
Характер оксида определяется природой элемента (металл или неметалл), его местом в периодической системе. Неметаллы образуют кислотные оксиды, металлы же образуют основные, кислотные и амфотерные оксиды. Проследим за изменением характера высших оксидов элементов III периода периодической системы Д.И.Менделеева:
Na2O, MgO Al2O3 SiO2, P2O5, SO3, Cl2O7
основные амфотерный кислотные
Металлы натрий и магний образуют основные оксиды, неметаллы кремний, фосфор, сера, хлор – кислотные. Алюминий стоит в периоде между металлом магнием и неметаллом кремнием, а поэтому должен иметь двойственные (амфотерные) свойства.
Металлы, проявляющие переменную степень окисления, образуют различные по характеру оксиды в зависимости от степени окисления. В низшей степени окисления оксиды имеют основной характер, в высшей – кислотный, в промежуточной – амфотерный. Например:
| Основные оксиды | Амфотерные оксиды | Кислотные оксиды |
| Cr+2O | Cr2+3 O3 | Cr+6O3 |
| Mn+2O, Mn2+3O3 | Mn+4O2 | Mn+6O3, Mn2+7O7 |
Получаются оксиды взаимодействием простых и сложных веществ с кислородом, а также разложением некоторых кислородсодержащих соединений при нагревании:
2Ca + O2 = 2CaO;
2ZnS + 3O2 = 2ZnO + 2SO2;
Cu(OH)2 = CuO + H2O.
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка (H2SO4, HNO3, HCl, H3PO4, H2CO3,). Кислоты взаимодействуют:
1. С основаниями с образованием соли и воды:
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O.
2. С основными и амфотерными оксидами с образованием соли и воды: 2HCl + BaO = BaCl2 + H2O;
H2SO4 + ZnO = ZnSO4 + H2O.
3. С солями с образованием новой соли и новой кислоты:
H2SO4 + Ba(NO3)2 = BaSO4 ↓+ 2HNO3.
Одним из способов получения кислот является взаимодействие кислотного оксида с водой: P2O5 + 3H2O = 2H3PO4.
Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами (NaOH, KOH, Cu(OH)2, Fe(OH)3). Основания взаимодействуют:
1. С кислотами с образованием соли и воды:
2NaOH + H2SO4 = Na2SO4 + 2H2O.
2. С кислотными и амфотерными оксидами с образованием соли и воды: 2KOH + CO2 = K2CO3 + H2O;
2NaOH + ZnO = Na2ZnO2 + H2O.
3. С солями с образованием новой соли и нового основания:
2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓
Гидроксиды металлов, которые взаимодействуют с кислотами и щелочами, называют амфотерными. К ним относятся: Zn(OH)2, Al(OH)3, Cr(OH)3, Be(OH)2, Sn(OH)2, Pb(OH)2.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O;
Zn(OH)2 + 2KOH = K2ZnO2 + 2H2O
Растворимые в воде основания (щелочи) получают взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
2Na + 2H2O = 2NaOH + H2↑
BaO + H2O = Ba(OH)2.
Нерастворимые в воде основания и амфотерные гидроксиды получают реакцией обмена: FeCl3 + 3KOH = Fe(OH)3↓ + 3KCl;
ZnSO4 + 2NaOH = Zn(OH)2↓ + Na2SO4.
Соли – это продукты замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток. Соли бывают средние, кислые, основные.
Средние соли ( K2SO4, Na3PO4, MgCl2) – это продукты полного замещения водорода в кислоте на металл:
2KOH + H2SO4 = K2SO4 + 2H2O.
Кислые соли (KHSO4, Na2HPO4, NaH2PO4) – это продукты неполного замещения водорода в кислоте на металл:
KOH + H2SO4 = KHSO4 + H2O.
Основные соли (MgOHNO3, (CuOH)2CO3, FeOHCl2) – это продукты неполного замещения гидроксильной группы в основании на кислотный остаток: Mg(OH)2 + HCl = MgCl2 + H2O
Лекция № 2. СТРОЕНИЕ АТОМА
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов.
Ядро атома состоит из протонов и нейтронов. Протон (р) – частица с относительной массой 1,0078 а.е.м. и условным зарядом +1. Число протонов в ядре (Z) равно порядковому номеру элемента в Периодической системе и определяет положительный заряд ядра. Нейтрон (n) – частица с относительной массой 1,0087 а.е.м. и зарядом 0. Число нейтронов в ядре (N) определяется по формуле N = A – Z, где А – атомная масса. Электрон (е) – элементарная частица с условным зарядом -1. Число электронов в нейтральном атоме равно заряду ядра и порядковому номеру элемента в Периодической системе. Все электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента.
Электроны характеризуются двойственной природой: они имеют свойства и частицы, и волны. Для движущегося электрона невозможно указать его точное местоположение, можно лишь определить вероятность нахождения электрона в различных частях внутриатомного пространства. Область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона, называется атомной орбиталью (АО). Орбиталь ограничена в трехмерном пространстве поверхностями той или иной формы. По форме различают 4 известных в настоящее время типа орбиталей – s, p, d и f.
Квантовые числа. Состояние электрона в атоме (т.е. совокупность информации об энергии электрона и пространстве, в котором он находится) характеризуется четырьмя квантовыми числами.
Главное квантовое число n определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Принимает значения целых чисел 1, 2, 3, 4… Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшую энергию имеют электроны первого от ядра энергетического уровня (n = 1); с увеличением n энергия электрона и его удаленность от ядра возрастают. Число энергетических уровней в атоме равно номеру периода, в котором находится элемент.
На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Поэтому энергетические уровни разделяются на подуровни. Энергию электрона на подуровне и форму атомной орбитали характеризует орбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n –1), т.е. 0, 1, 2, 3… (n –1). В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l, называется энергетическим подуровнем. Подуровни обозначают буквами:
орбитальное квантовое число l 0 1 2 3
обозначение энергетического подуровня s p d f.
Для первых четырех уровней число подуровней равно номеру уровня. Пятый, шестой и седьмой уровни содержат по четыре подуровня. При данном значении главного квантового числа n наименьшую энергию имеют электроны s -подуровня, затем p-, d-, f- подуровней.
Каждый подуровень составлен из орбиталей, число их определяется магнитным квантовым числом ml. Магнитное квантовое число ml определяет возможные ориентации орбитали в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l+1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве.
Для s -подуровня l = 0 и потому ml имеет единственное значение: ml = 0. Таким образом, на s -подуровне имеется единственная s -орбиталь, которая расположена симметрично ядру атома. Для p -подуровня l = 1 и, таким образом, ml приобретает три значения: –1, 0, 1, и р- подуровень имеет три р -орбитали и они ориентированы по трем осям координат. d -подуровень с l = 2 имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять d -орбиталей, которые ориентированы по пяти разным направлениям. f -подуровень с l = 3 имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т.е. семь f- орбиталей. Число ориентаций f- орбиталей равно семи.


 Условно АО обозначают в виде квадрата (квантовой ячейки) š. Соответственно для s -подуровня имеется одна АО š, для p -подуровня – три АО, для d -подуровня пять АО, для f- подуровня семь АО.
Условно АО обозначают в виде квадрата (квантовой ячейки) š. Соответственно для s -подуровня имеется одна АО š, для p -подуровня – три АО, для d -подуровня пять АО, для f- подуровня семь АО.
Таким образом, электроны в атоме располагаются по энергетическим уровням, удаленность которых от ядра характеризуется значением главного квантового числа n; уровни состоят из подуровней, число которых для каждого уровня не превышает значение n; в свою очередь, подуровень состоит из орбиталей, количество которых задается числом значений магнитного квантового числа ml. Квантовые числа n, l, ml характеризуют орбиталь.
Кроме движения вокруг ядра, электрон вращается вокруг собственной оси. Это движение получило название «спин». Спиновое квантовое число ms характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против нее). Спиновое квантовое число ms принимает два значения: +½ и –½. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↓↑.
Принципы распределения электронов в атоме. Распределение электронов в атоме осуществляется в соответствии с тремя положениями квантовой механики: принципом Паули; принципом минимальной энергии; правилом Хунда.
Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. На одной орбитали могут находиться максимум два электрона с противоположно направленными спинами  . Максимальное число электронов на энергетическом уровне определяется как 2 n 2, а на подуровне – как 2(2 l +1).
. Максимальное число электронов на энергетическом уровне определяется как 2 n 2, а на подуровне – как 2(2 l +1).
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно которому электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии, и соответственно, заполнение орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) – в порядке возрастания n.
Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией. При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…,подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Так, электронная конфигурация атома серы имеет вид 16S 1 s 22 s 22 p 63 s 23 p 4, а ванадия 23V 1 s 22 s 22 p 63s23 p 6 3 d 34 s 2.
Электронная конфигурация атома может быть изображена также в виде схем размещения электронов в квантовых ячейках. В каждой квантовой ячейке может быть не более двух электронов с противоположно направленными спинами  . Порядок размещения электронов в пределах одного подуровня определяется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным.
. Порядок размещения электронов в пределах одного подуровня определяется правилом Хунда: в пределах подуровня электроны размещаются так, чтобы их суммарный спин был максимальным.
Часто графически изображают не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны, например,
16S…3 s 2 3 p 4 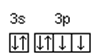 ; 23V…3 d 34 s 2
; 23V…3 d 34 s 2  .
.
Суммарный спин р- электронов третьего энергетического уровня атома серы S ms = ½ – ½ + ½ + ½ = 1; d -электронов атома ванадия – S ms = ½ + ½ + ½ = 3/2.
Химические свойства атомов определяются, в основном, строением внешних энергетических уровней, которые называются валентными. В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f- элементы. Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами. У р-элементов последним заполняется р-подуровень внешнего уровня. У d-элементов в последнюю очередь заполняется d-подуровень предвнешнего уровня. У f- элементов последним заполняется f-подуровень третьего снаружи энергетического уровня.
Лекция № 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА
Современное представление об элементах стало возможным лишь после открытия Д.И. Менделеевым (1869) периодического закона, формулировка которого в настоящее время следующая: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов. Наглядным выражением закона служит периодическая система Д. И. Менделеева.
По горизонтали в периодической системе расположено 7 периодов, из которых три малых (1-3) и четыре больших (4-7). Начало каждого периода сопровождается образованием нового энергетического уровня. Любой период начинаются щелочным металлом (… ns1) и заканчивается благородным газом (… ns2np6 или ns2 у первого периода). Металлические свойства рассматриваются, как способность атомов элемента легко отдавать электроны (восстановительные свойства), а неметаллические – присоединять электроны (окислительные свойства). В периодах с возрастанием порядкового номера элемента усиливаются неметаллические и окислительные свойства, а металлические и восстановительные ослабевают. Этосвязано с тем, что число энергетических уровней у элементов одного и того же периода не изменяется, а заряд ядра возрастает, и связь электронов с ядром усиливается.
Усиление неметаллических свойств в пределах данного периода иллюстрируется изменением характера оксидов и гидроксидов, образуемых элементами этого периода. В периодах при переходе слева направо происходит усиление кислотных и ослабление основных свойств высших оксидов и соответствующих им гидроксидов.
По вертикали в таблице расположено 8 групп, что соответствует максимальному числу электронов на внешних энергетических уровнях. Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами и, следовательно, сходными свойствами (элементы-аналоги). В главных (А) подгруппах расположены s -элементы (I, II группы) и p -элементы (III-VIII группы). В атомах элементов главных подгрупп валентные электроны находятся на s - и р -подуровнях внешнего энергетического уровня и общее их число равно номеру группы. В главных подгруппах при переходе сверху вниз усиливаются металлические свойства, основной характер соединений и их устойчивость в низшей степени окисления. Например, для элементов IV А-группы возможные степени окисления +2 и +4. Для углерода наиболее характерна степень окисления +4, поэтому четырехвалентные соединения углерода устойчивы и не проявляют окислительных свойств. У свинца металлические свойства выражены сильнее, чем у углерода и для него характерна степень окисления +2, вследствие чего соединения свинца со степенью окисления +4 являются окислителями.
В побочных (В) подгруппах располагаются d- и f- элементы. Валентные электроны в атомах d- элементов находятся на s- подуровне внешнего и d- подуровне предвнешнего энергетических уровней и их максимальное число равно номеру группы. В побочных подгруппах, кроме подгруппы скандия, при переходе сверху вниз усиливаются неметаллические свойства, кислотный характер соединений и их устойчивость в высшей степени окисления.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 529; Нарушение авторских прав?; Мы поможем в написании вашей работы!