
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Типы окислительно-восстановительных реакций
|
|
|
|
Различают три типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, диспропорционирования. Межмолекулярные окислительно-восстановительные реакции - это реакции, в которых окислитель и восстановитель находятся в разных веществах. Рассмотренная выше реакция относится к этому типу. К внутримолекулярным относятся реакции, в которых окислитель и восстановитель находятся в одном и том же веществе.
2KCl+5O3-2 = 2KCl-1 + 3O20
восстановление Сl+5 + 6ē → Cl- ½2 Cl+5 - окислитель
окисление 2O-2 - 4ē → O20 ½3 O-2 - восстановитель
В реакциях диспропорционирования (самоокисления - самовосстановления) молекулы одного и того же вещества реагируют друг с другом как окислитель и как восстановитель.
3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4KOH
окисление Mn+6 - ē → Mn+7 ½ 2 Mn+6 - восстановитель
восстановление Mn+6 + 2ē → Mn+4 ½ 1 Mn+6 – окислитель
Лекция № 11. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Процессы взаимного превращения химической и электрической форм энергии называют электрохимическими. Они делятся на две основные группы: 1) процессы превращения химической энергии в электрическую (в гальванических элементах); 2) процессы превращения электрической энергии в химическую (электролиз).
Электродные потенциалы. При погружении металла в раствор его соли атомы металла, находящиеся на поверхности, превращаются в ионы и, гидратируясь, переходят в раствор. При этом электроны, остающиеся на металле в избытке, заряжают его поверхностный слой отрицательно. В то же время гидратированные ионы металла, находящиеся в растворе, отбирая у металлической пластинки электроны, образуют атомы металла, которые становятся частью кристаллической решетки. Этот процесс приводит к дефициту электронов и возникновению на пластинке положительного заряда. Таким образом, между металлическим электродом и раствором устанавливается равновесие М 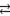 Мn+ + nē.
Мn+ + nē.
Разность потенциалов, которая возникает на границе металл-раствор, называется электродным потенциалом. Абсолютное значение электродного потенциала измерить невозможно. Поэтому электродные потенциалы определяют относительно стандартного водородного электрода, потенциал которого условно принят за ноль. Электродный потенциал, измеренный при стандартных условиях (т.е. при температуре 250С и концентрациями веществ, участвующими в процессе, равных 1моль/л) по отношению к стандартному водородному электроду, называется стандартным электродным потенциалом. Обозначается j0, измеряется в вольтах.
Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы.
Последовательность металлов в ряду напряжений сохраняется только для стандартной температуры (25 °С) и концентрации ионов металла в растворе 1 моль/л. При других концентрациях электролита электродный потенциал рассчитывается по уравнению Нернста:
j = j0 + 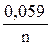 lgC
lgC
где jo – стандартный электродный потенциал, n – число электронов, участвующих в электродной реакции; C – концентрация ионов металла в растворе.
Гальванические элементы. Два электрода, погруженные в растворы электролитов, соединенные металлическим проводником, образуют гальванический элемент. Гальваническими элементами называют устройства, в которых химическая энергия окислительно-восстановительных процессов преобразуется в электрическую энергию.
Так, реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля-Якоби, схема которого
(–)Zn|ZnSO4||CuSO4|Cu(+)
отражает систему обозначений для гальванических элементов:
- слева записывается анод Zn|Zn2+ – электрод, имеющий меньшее значение электродного потенциала, отрицательный полюс (–), на нем протекает процесс окисления – анодная реакция: Zn –2ē = Zn2+;
- справа записывается катод Cu2+|Cu – электрод, имеющий большее значение электродного потенциала, положительный полюс (+), на нем протекает процесс восстановления – катодная реакция: Cu2+ + 2ē = Cu;
- одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита, двойная вертикальная линия отделяет анодное пространство от катодного.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В случае элемента Даниэля-Якоби токообразующая реакция имеет вид:
Cu2+ + Zn = Cu + Zn2+.
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС). Обозначается E, измеряется в вольтах. ЭДС элемента равна разности потенциалов катода и анода:
E = jк – jа.
Стандартная ЭДС равна разности стандартных электродных потенциалов катода и анода: E0 = j0к – j0а.
Так, для элемента Даниэля – Якоби стандартная ЭДС равна:
Eo = joСu2+/Cu – j0Zn2+/Zn = +0,337 – (–0,763) = +1,100 В.
Окислительно-восстановительная реакция, характеризующая работу гальванического элемента, протекает в направлении, в котором ЭДС имеет положительное значение. В этом случае DG0х.р. < 0, так как энергия Гиббса химической реакции и ЭДС связаны соотношением
DG0 = – nE0F,
где n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея, равная 96500 Кл; E0– стандартная ЭДС.
Гальванический элемент, состоящий из двух электродов одного и того же металла, погруженных в растворы его соли разной концентрации, представляет собой концентрационный элемент. В этом случае электрод, погруженный в раствор электролита с меньшей концентрацией ионов металла, будет анодом, с большей концентрацией – катодом.
Электролиз – совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Сущность электролиза заключается в том, что при пропускании тока через раствор или расплав электролита положительно заряженные ионы перемещаются к катоду (отрицательному электроду), а отрицательно заряженные – к аноду (положительному электроду). Достигнув электродов, ионы разряжаются: у анода восстановитель отдает электроны (в сеть) и окисляется; у катода окислитель присоединяет электроны (из сети) и восстанавливается.
Например, при прохождении электрического тока через расплав MgCl2 катионы магния под действием электрического поля движутся к катоду и восстанавливаются на нем до металла
Mg2+ + 2ē = Mg.
Анионы хлора перемещаются к аноду и окисляются на нем с образованием молекул газообразного хлора
2С1– – 2ē = С12.
Суммарный процесс, протекающий при электролизе, выражается уравнением окислительно-восстановительной реакции
Mg2+ + 2С1– = Mg + С12.
При электролизе водных растворов, кроме ионов электролита в окислительно-восстановительном процессе принимают участие молекулы воды.
На катоде молекулы воды могут восстанавливаться
2Н2О + 2ē = Н2 + 2ОН– (j = –0,41 В),
а на аноде – окисляться
2Н2О – 4ē = 4Н+ + О2 (j = +1,23 В).
Характер катодного процесса при электролизе водных растворов определяется положением металла в ряду напряжений. На катоде в первую очередь восстанавливаются катионы, имеющие наибольшее значение электродного потенциала. Если катионом электролита является металл, электродный потенциал которого значительно более отрицательный, чем ‑0,41 В, то на катоде металл восстанавливаться не будет, а произойдет восстановление молекул воды. Эти металлы расположены в ряду напряжений от Li по Al включительно. Если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41 В, то из нейтрального раствора такого электролита на катоде будет восстанавливаться металл. Такие металлы находятся в ряду напряжений после водорода. В случае ионов металлов, имеющих значения потенциала близкие к –0,41 В (Zn, Cr, Fe, Cd, Ni), в зависимости от концентрации электролита и условий электролиза, возможно как восстановление металла, так и выделение водорода, а нередко и их совместный разряд.
На аноде в первую очередь осуществляется окисление наиболее сильных восстановителей – ионов, имеющих меньшее значение электродного потенциала.
Различают электролиз с инертным (нерастворимым) анодом и электролиз с активным (растворимым) анодом.
Активный анод изготовлен из материала, который при электролизе может окисляться по схеме: М0 – nē = Mn+.
Инертный анод (графит, уголь, платина) не претерпевает окисления в ходе электролиза. При электролизе водных растворов щелочей, кислородсодержащих кислот (HNO3, H2SO4, H3PO4) и их солей (нитраты, сульфаты, ортофосфаты и др.), а также фтороводорода и фторидов на таком аноде происходит электрохимическое окисление воды. Если анионы электролита не содержат атомы кислорода (Сl–, Br–, I–, S2–), то на аноде в ходе электролиза они и разряжаются. Например, 2С1– – 2ē = С12.
Законы электролиза (М. Фарадей):
1. Количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества. При превращении одного моля эквивалентов вещества на электроде через него проходит 96500 Кл электричества.
2. Массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Первый и второй законы электролиза описываются объединенным уравнением:
m 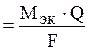 ,
,
где Q=I×t, m – масса вещества, выделившегося на электроде (г), Mэк – молярная масса эквивалентов вещества, выделившегося на электроде (г/моль); Q – количество электричества, прошедшее через электролит (Кл); I – сила тока (А), t – время электролиза (с).
Если на электродах выделяются газы, то можно воспользоваться формулой:
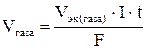 ,
,
где Vгаза – объем газа, выделившегося на электроде (л), Vэк(газа) – объем 1 моль эквивалентов газа, выделившего на электроде (л).
Выход по току – выраженное в процентах отношение массы вещества, фактически выделившегося на электроде, к теоретически вычисленному ее значению:
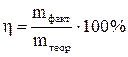 .
.
Лекция № 12. КОРРОЗИЯ МЕТАЛЛОВ. МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой. По характеру разрушения металла различают равномерную и местную коррозию. Равномерная коррозия распределяется по всей поверхности металла, а местная сосредоточена на отдельных участках и проявляется в виде точек, язв или пятен. Местная коррозия более опасна, чем равномерная, т.к. процесс проникает на большую глубину. Особыми видами коррозии являются межкристаллическая коррозия (коррозия по границам зерен), избирательная коррозия (растворение одного компонента сплава) и коррозионное растрескивание (коррозия при одновременном воздействии химических реагентов и высоких механических напряжений).
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию. Химической коррозией называется окисление металла, не сопровождающееся возникновением в системе электрического тока. Такой механизм наблюдается при взаимодействии металлов с агрессивными газами при высокой температуре (газовая коррозия) и с органическими жидкими неэлектролитами (коррозия в неэлектролитах).
Электрохимической коррозией называется разрушение металла в среде электролита, сопровождающееся возникновением внутри системы электрического тока. Электрохимическая коррозия протекает по механизму действия гальванического элемента. На поверхности металла одновременно протекают два процесса:
анодный – окисление металла М – nē ® Мn+
катодный – восстановление окислителя (Ох): Ох + nē ® Red.
Наиболее распространенными окислителями при электрохимической коррозии являются молекулы О2 воздуха и ионы водорода Н+ электролита, восстановление которых на катоде протекают по уравнениям:
О2 + 2Н2О + 4ē ® 4ОН– – в нейтральной или щелочной среде
2Н+ + 2ē ® Н2 – в кислой среде.
Например, при контакте железа с медью в растворе электролита – соляной кислоты – на аноде идет процесс окисления железа: Fe – 2ē = Fe2+
на катоде – процесс восстановления ионов водорода: 2H+ + 2ē = H2
В результате железо разрушается, а на меди выделяется водород. Схема образующегося при этом гальванического элемента имеет вид:
(–) Fe½HCl½Cu (+)
При контакте железа с медью во влажном воздухе (O2 + Н2O) процесс коррозии выражается уравнениями:
на аноде: Fe – 2ē = Fe2+
на катоде: O2 + 2Н2O +4ē = 4OH–
Схема образующегося гальванического элемента: (–) Fe½O2, Н2O½Cu (+)
Возникающие в результате коррозии ионы Fe2+ соединяются с гидроксильными группами, выделяющимися на катоде: Fe2 + 2OH– = Fe(OH)2. Далее Fe(OH)2 окисляется в Fe(OH)3: 4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3, который частично теряет воду и превращается в ржавчину.
Электрохимической коррозии подвергаются не только разнородные металлы, находящиеся в контакте друг с другом, но и технические металлы и сплавы. Технические металлы содержат примеси других металлов, а сплавы состоят из микроскопически малых кристаллов двух или нескольких различных металлов. При соприкосновении с электролитом таких неоднородных по микроструктуре металлов на их поверхности возникают микрогальванопары и протекает электрохимическая коррозия.
К возникновению гальванических пар, а, следовательно, к коррозии могут также привести:
1. Неравномерная адсорбция кислорода на поверхности металла. В этом случае на поверхности металла образуется гальваническая пара особого вида: участок металла, в большей степени покрытый адсорбированными молекулами кислорода, будет играть роль катода, а участок, к которому доступ кислорода затруднен, будет анодом.
2. Контакт обнаженного участка металла с участком, покрытым его соединением, в частности пленкой.
3. Механическая обработка металла, которая изменяет электродный потенциал. Соприкосновение двух участков – деформированного и недеформированного – приведет к образованию гальванопары. Коррозии будет подвергаться деформированный участок поверхности.
4. Неравномерное наложение внешнего электрического поля. Анодные и катодные участки могут возникнуть под действием «блуждающих токов», исходящих от трамваев, метро, электрических железных дорог. Вследствие плохого контакта рельсов на стыках и недостаточной изоляции их от земли, ток выходит в почву и находит пути с низким сопротивлением, например, подземные трубопроводы, электрокабели. Возникают гальванопары. Роль катода выполняют рельсы, а анода – подземные металлические сооружения, которые и разрушаются.
Защита металлов от коррозии. Все методы защиты металлов от коррозии условно делят на следующие группы:
- легирование;
- изоляция металла от окружающей среды с помощью покрытий;
- электрохимическая защита;
- изменение свойств коррозионной среды;
-рациональное конструирование металлических изделий.
Легирование металлов осуществляют для защиты металлов от высокотемпературной газовой коррозии. Легирование – это введение в состав сплава компонентов, вызывающих пассивацию металла (Cr, Ni, Mo, W, Ti).
Защитные покрытия от низкотемпературной коррозии могут быть:
а) неметаллические (лаки, краски, смолы, полимерные пленки);
б) металлические. Различают катодные и анодные покрытия. Покрытие защищаемого металла менее активным металлом называется катодным. Катодными, например, являются покрытия на стали из меди, никеля, серебра. При повреждении таких покрытий защищаемый металл становится анодом и окисляется. Покрытие защищаемого металла более активным металлом называется анодным. Анодными, например, являются покрытия на стали из алюминия, цинка, хрома. В этом случае защищаемый металл будет катодом коррозионного элемента, поэтому он не корродирует, а окисляться будет металл покрытия.
в) химические. Поверхность металла подвергают химической обработке с целью получения на нем пленки его химического соединения, стойкой против коррозии.
К электрохимическим методам защиты относятся:
а) катодная защита заключается в том, защищаемая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока, становясь катодом. К аноду источника тока присоединяют железный лом, помещенный в ту же среду.
б) протекторная защита заключается в образовании гальванической пары, в которой защищаемый металл играет роль катодного участка, а анодом – протектором – служит более активный металл или сплав (алюминий, магний, цинк, их сплавы). Протекторы наклепывают или соединяют металлическим проводом с защищаемой конструкцией.
Изменение свойств коррозионной среды. Изменить свойства коррозионной среды можно:
а) уменьшением концентрации веществ, вызывающих коррозию;
б) введением в агрессивную среду ингибиторов – веществ, замедляющих коррозию. По механизму действия на процесс коррозии ингибиторы делятся на адсорбционные (адсорбируются на коррозирующей поверхности и тормозят анодные и катодные процессы) и пассивационные (вызывают образование на поверхности металла защитных пленок и пассивацию металла).
Рациональное конструирование изделий. Изделие должно быть таковым, чтобы как можно меньше было участков, на которых может возникнуть коррозия (сварных швов, узких щелей, контактов разнородных металлов). Машина не должна иметь мест скопления влаги, вызывающей коррозию.
Лекция № 13. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
Положение металлов в периодической системе. Металлы составляют 80% всех элементов. Если в периодической таблице элементов Д.И. Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы- Sb и др.), обладают двойственным характером свойств.
К металлам относятся s - элементы I и II групп, все d- (переходные) и f-элементы (лантаноиды и актиноиды), а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb, Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Распространенность металлов в земной коре. Из металлов наиболее распространен в природе Al (8,8% от массы земной коры), далее идут Fe – 4,6%, Ca - 3,6%, Na - 2,6%, K - 2,5%, Mg - 2,1%, Ti - 0,6%.
В большинстве случаев металлы находятся в природе в виде различных соединений и только малоактивные металлы, как например Pt, Cu, Au, Ag встречаются в свободном виде.
Из природных соединений металлов наиболее распространенными являются следующие:
Оксиды. В виде оксидов встречаются тяжелые (Fe2O3, Fe3O4, Cu2O, MnO2, Mn3O4, SnO2, Fe(CrO2)2, FeTiO3) и легкие металлы (Al2O3, TiO2).
Сульфиды. В виде сульфидов встречаются тяжелые малоактивные металлы: CuS, Cu2S, Ag2S, ZnS, HgS, CdS, PbS, MoS2, CoS, NiS, FeS2.
Сульфаты. В виде сульфатоа встречаются в основном легкие металлы: Na2SO4, MgSO4, CaSO4, SrSO4, BaSO4, K2SO4.
Карбонаты. В виде карбонатов встречаются легкие и редко тяжелые металлы: Na2CO3, K2CO3, MgCO3, CaCO3, SrCO3, BaCO3, (CuOH)2CO3, ZnCO3, PbCO3, FeCO3, MnCO3.
Галиды. В виде галидов встречаются легкие металлы: NaCl, KCl, MgCl2, CaCl2, CaF2, Na3[AlF6].
Получение металлов из руд. Руды – горные породы, из которых извлекают металл. Руды почти всегда загрязнены пустой породой, поэтому первоначальной задачей при получении металлов из руды является отделение пустой породы и разделение остатка на различные фракции – обогащение руды. Последующие операции заключаются в получении соединения металла, из которого удобно его выделить. Так сульфидные и карбонатные руды предварительно обжигают:
2ZnS + 3O2 –t°→ 2ZnO + 2SO2; FeCO3 –t°→ FeO + CO2
Полиметаллические руды обрабатывают хлором. При этом образуются хлориды различных металлов, которые обладают разной летучестью, вследствие чего легко отделяются друг от друга. Хлориды отдельных металлов удобно подвергать восстановлению до свободных металлов. Руды с малым содержанием отдельных металлов обрабатывают водными растворами кислот или шелочей. Подготовленную руду подвергают восстановлению. Восстановление металлов осуществляется посредством пирометаллургических, гидрометаллургических процессов и электролиза. Пирометаллургический процесс – это восстановление металлов из их безводных соединений при высокой температуре. В качестве восстановителей используются H2, СО, С или более активный металл. Процесс восстановления металлов другим металлом называется металлотермией. В качестве восстановителей в металлотермии используются Al, Mg, Ca, Na. Металлотермией получают тугоплавкие металлы, например V, Cr, Mn.
Cr2O3 + 2Al –t°→ Al2O3 + 2Cr
В настоящее время с развитием методов хлорирования в металлургии большое значение приобрело металлотермическое восстановление хлоридов. Так получают Ti, Zr, Hf, Nb, Ta.
TiCl4 + 2Mg –t°→ Ti + 2MgCl2
Углерод и оксид углерода СО используют для восстановления таких сравнительно малоактивных металлов, как Fe, Cu, Zn, Pb.
Cu2O + C = 2Cu + CO; Fe2O3 + 3C = 2Fe + 3CO
Реакции восстановления углеродом часто сопровождаются образованием карбидов, поэтому в ряде случаев неприменимы. Для получения металлов, свободных от углерода, применяют в качестве восстановителя водород:
WO3 + 3H2 = W + 3H2O
Гидрометаллургический процесс - это восстановление металлов из растворов их соединений при невысоких температурах. Используется для получения металлов с низким содержанием в руде. В качестве восстановителей могут быть или более активные металлы, или электроны катода при электролизе.
В качестве примера можно привести гидрометаллургическую переработку золота. Его растворяют в разбавленных растворах цианистых щелочей по реакции:
4Au + 8KCN + O2 + 2H2O = 4K[Au(CN)2] + 4KOH
Золото растворяется, а кварц, из которого золото извлекают, остается в осадке. Золото отфильтровывают от кварца и действуют цинковой пылью:
2K[Au(CN)2] + Zn = K2[Zn(CN)4] + 2Au
Снова фильтруют, на фильтре остается золото.
Электролизом из растворов осаждают медь, никель, серебро, хром, кадмий, индий, олово и другие металлы. Электролизом из расплавов осаждаются сильные восстановители, такие как щелочные металлы, магний, алюминий.
Физические свойства металлов. Металлы – твердые кристаллические вещества, кроме ртути, обладающие пластичностью, металлическим блеском, непрозрачностью, высокой электропроводностью и теплопроводностью.
Свойства металлов объясняются наличием металлической связи (присутствием свободных электронов, т.е. «электронного газа»).
1. Пластичность – способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. При механическом воздействии на металл отдельные слои его кристаллической решетки смещаются друг относительно друга, происходит перераспределение электронного газа, связывающего атомы металла друг с другом. При этом химические связи не разрываются, и металл деформируется, не разрушаясь. В ряду – Au, Ag, Cu, Sn, Pb, Zn, Fe – пластичность уменьшается.
2. Блеск, обычно серый цвет и непрозрачность. Непрозрачность обусловлена присутствием свободных электронов, которые гасят световые колебания, превращая их энергию в тепло. Серый цвет металлов объясняется тем, что металлы почти полностью отражают свет всех длин волн спектра.
3. Высокая электропроводность объясняется направленным движением свободных электронов от отрицательного полюса к положительному полюсу под влиянием небольшой разности потенциалов. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа». Лучшие проводники электрического тока Ag, Cu, Au, Al.
4. Высокая теплопроводность обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшую теплопроводность имеют Ag, Cu, Au, Al, наименьшую - ртуть и висмут.
5. Твердость. Самый твердый металл – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6. Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий – литий (ρ = 0,53 г/см3); самый тяжелый – осмий (ρ = 22,6 г/см3)). Металлы, имеющие ρ < 5 г/см3, считаются «легкими металлами».
7.Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (tпл = -39°C), самый тугоплавкий металл – вольфрам (tпл = 3390°C). Металлы с tпл выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Химические свойства металлов. На внешнем уровне у металлов содержится 1,2,3 электрона, поэтому все металлы являются восстановителями: Me0 – nē = Me+n
Реакции металлов с неметаллами:
1. С кислородом: 2Mg + O2 → 2MgO (оксиды)
2. С серой: Мg + S → МgS (сульфиды)
3. С галогенами: Ni + Cl2 –t°→ NiCl2 (хлориды)
4. С азотом: 3Ca + N2 –t°→ Ca3N2 (нитриды)
5. С фосфором: 3Ca + 2P –t°→ Ca3P2 (фосфиды)
6. С углеродом: 2Li + 2C → 2Li2C2 (карбиды)
7. С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 → 2LiH (гидриды)
Реакции металлов с кислотами:
1. Металлы, стоящие в электрохимическом ряду напряжений до H, восстанавливают водород из разбавленных кислот (за исключением HNO3):
Mg + 2HCl → MgCl2 + H2↑
2Al+ 6HCl → 2AlCl3 + 3H2↑
2. Взаимодействие металлов с кислотами-окислителями:
Концентрированная H2SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до SO2 (с тяжелыми металлами), S или H2S (с активными металлами). А такие металлы как Fe, Al, Cr без нагревания не реагируют – пассивируются.
Cu + 2H2SO4 (конц) → CuSO4 + SO2↑ + 2H2O
4Zn + 5H2SO4 (конц) → 4ZnSO4 + H2S↑ + 4H2O
Азотная кислота HNO3 – сильный окислитель, при взаимодействии HNO3 с металлами никогда не выделяется водород. Концентрированная HNO3 такие металлы, как Fe, Al, Cr, Au, Pt, без нагревания пассивирует, с тяжелыми металлами образует NO2, со щелочными и щелочноземельными металлами – N2O.
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
4Mg + 10HNO3 (конц.)→ 4Mg(NO3)2 + N2O↑ + 5H2O
Разбавленная HNO3 с тяжелыми металлами образует NO, со щелочными и щелочно-земельными металлами, а также Zn, Sn и Fe – NH4NO3.
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
4Ca + 10HNO3(оч.разб.) → 4Ca(NO3)2 + NH4NO3 + 3H2O
Взаимодействие с водой:
1. Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na + 2H2O → 2NaOH + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Металлы средней активности окисляются водой при нагревании до оксида: Zn + H2O = ZnO + H2
3. Неактивные металлы (Au, Ag, Pt) с водой не реагируют.
Лекция № 14. Химия s-металлов
s-металлы расположены в главных подгруппах I и II групп периодической системы. В IА группе расположены щелочные металлы литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. Электронная конфигурация их внешнего электронного слоя – ns1. В главной подгруппе II группы находятся бериллий Be, магний Mg и щелочноземельные металлы кальций Ca, стронций Sr, барий Ba, радий Ra. Конфигурация внешнего электронного слоя – ns2. На предвнешнем уровне у атомов s-металлов содержится 8 электронов, у лития и бериллия – 2 электрона. Литий по ряду свойств ближе к магнию, а бериллий сходен с алюминием и является типичным амфотерным элементом.
Нахождение в природе, получение. Наиболее распространенным элементом в земной коре среди s-металлов является кальций. Он занимает пятое место по распространенности в земной коре, уступая только кислороду, кремнию, алюминию и железу. Так как металлы главных подгрупп I-II групп являются активными, то в природе они встречаются только в виде соединений.
Щелочные металлы получают электролизом расплавов их хлоридов или оснований 2NaCl → 2Na + Cl2↑
катод: 2Na+ + 2ē → 2Na0
анод: 2Clˉ – 2ē → 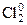 ↑
↑
бериллий получают восстановлением фторида
BeF2 + Mg –t°→ Be + MgF2
барий получают восстановлением оксида
3BaO + 2Al –t°→ 3Ba + Al2O3,
магний, кальций, стронций получают электролизом расплавов хлоридов
CaCl2 → Ca + Cl2↑
катод: Ca2+ + 2ē → Ca0
анод: 2Clˉ – 2ē → 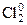 ↑
↑
Физические и химические свойства. Щелочные металлы характеризуются низкими температурами плавления, малыми значениями плотностей, они мягкие и режутся ножом. Щелочноземельные металлы по сравнению со щелочными обладают более высокими температурами плавления и кипения, плотностями и твердостью. Литий – самый легкий металл. Легче воды всего три металла: литий, натрий и калий.
Все щелочные металлы – очень сильные восстановители, в соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается в ряду Li-Na-K-Rb-Cs. Все соединения щелочных металлов имеют ионный характер. Практически все соли растворимы в воде.
Металлы главной подгруппы II группы – сильные восстановители; в соединениях проявляют только степень окисления +2. Активность металлов и их восстановительная способность увеличивается в ряду: Be-Mg-Ca-Sr-Ba.
Отношение к кислороду. С кислородом s -металлы энергично реагируют. На воздухе они (кроме Ве и Мg) окисляются, а Rb и Сs самовоспламеняются. Близкий по твердости к свинцу, барий загорается на воздухе уже при простом раздавливании. Среди щелочных металлов только литий, сгорая, образует нормальный оксид:
4Li + O2 → 2Li2O.
Остальные же металлы превращаются в пероксид (Na2O2) и супероксиды (КО2, RbO2, СsО2). Пероксиды s -металлов обладают окислительно-восстановительной двойственностью:
Na2O2 + 2КI + 2H2SO4 → I2 + Na2SO4 + K2SO4 + 2H2O
5Na2O2 + 2KMnO4 + 8H2SO4 → 5O2 + 2MnSO4 + 5Na2SO4 + K2SO4 + 8H2O
Они являются солями слабой кислоты Н2О2 и подвергаются полному гидролизу:
Na2O2 + 2H2O → 2NaOH + H2O2
BaO2 + 2H2O → Ba(OH)2 + H2O2.
Оксиды щелочных металлов, кроме оксида лития, получают при нагревании смеси пероксида или надпероксида с избытком металла:
Na2O2 + 2Na → 2Na2O
KO2 + 3K → 2K2O
Оксиды щелочноземельных металлов получают окислением металлов (кроме Ba, который образует пероксид) или термическим разложением нитратов или карбонатов:
CaCO3 –t°→ CaO + CO2↑
2Mg(NO3)2 –t°→ 2MgO + 4NO2↑ + O2↑
Оксиды щелочных и щелочноземельных металлов – типичные основные оксиды. Реагируют с водой (кроме BeO), кислотными оксидами и кислотами:
Li2O + H2O → 2LiOH MgO + H2O → Mg(OH)2
Na2O + SO3 → Na2SO4 MgO + H2O → Mg(OH)2
K2O + 2HNO3 → 2KNO3 + H2O 3CaO + P2O5 → Ca3(PO4)2
BeO+2HNO3→Be(NO3)2+H2O
BeO – амфотерный оксид, поэтому растворяется не только в кислотах, но и в щелочах:
BeO + 2NaOH + H2O → Na2[Be(OH)4]
Бериллий и магний на воздухе покрываются тонкой пленкой оксида и гидроксида, приобретают матовый оттенок, но глубокому разрушению не подвергаются.
Отношение к другим окислительным элементам. Со всеми окислительными элементами s-металлы образуют бинарные соединения (-иды): гидриды, галогениды, оксиды, сульфиды, селениды, теллуриды, нитриды, фосфиды, арсениды, карбиды, силициды и бориды.
С водородом щелочные и щелочноземельные металлы образуют ионные гидриды:
2Na + H2 → 2NaH Ca + H2 → CaH2.
Ионные гидриды являются сильными восстановителями и имеют основной характер:
BaH2 + 2H2O → Ba(OH)2 + 2H2.
Непосредственно с водородом не реагируют бериллий и магний.
Галогениды представляют собой кристаллические вещества белого цвета, хорошо растворимые в воде (мало растворимы LiF, MgF2). Несмотря на то, что все s-металлы непосредственно окисляются галогенами, получают галогениды в основном по реакции обмена или нейтрализации:
СаСО3 + 2НBr → CaBr2 + H2O + CO2
Be(OH)2 + 2HF → BeF2 + 2H2O.
С серой s-металлы взаимодействуют при нагревании, образуя сульфиды, например: 2Li + S →Li2S Sr + S → SrS.
Сульфиды щелочных металлов хорошо растворимы в воде, сульфиды BeS, CaS, SrS, BaS – малорастворимы, а MgS водой разлагается. Являясь солями слабой сероводородной кислоты, сульфиды s-металлов гидролизуются по аниону:
S2– + Н2О ↔ НS– + OH–
Na2S + H2O ↔NaHS +NaOH
2CaS + 2H2O ↔ Ca(HS)2 +Ca(OH)2.
С азотом при обычных условиях реагирует только литий:
6Li + N2 → 2Li3N.
Остальные s -металлы реагируют с азотом лишь при нагревании:
3Мg + N2 → Mg3N2.
Нитриды легко разлагаются водой и имеют основной характер:
Са3N2 + 6H2O → 3Ca(OH)2 + 2NH3.
С углеродом при нагревании реагирует литий, расплавленный бериллий и щелочноземельные металлы, при этом образуются карбиды (ацетилениды и метаниды): 2Li + 2C → Li2C2 2Be + C → Be2C.
Эти солеподобные карбиды разлагаются водой:
Li2C2 + 2H2O → 2LiOH + C2H2
Be2C + 4H2O → 2Be(OH)2 + CH4.
Отношение к воде. Щелочные и щелочноземельные металлы энергично реагируют с водой при комнатной температуре, причем активность взаимодействия возрастает с увеличением порядкового номера элемента:
2Na + 2H2O → 2NaOH + H2
Ba + 2H2O → Ba(OH)2 + H2.
Магний реагирует только с кипящей водой или при обычных условиях в присутствии хлорида аммония:
Mg + 2H2O 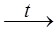 Mg(OH)2 + H2
Mg(OH)2 + H2
Mg + 2H2O + 2NH4Cl → MgCl2 + 2NH4OH + H2.
Амфотерный бериллий растворяется в воде в присутствии щелочи:
Be + 2H2O + 2NaOH → Na2[Be(OH)4] + H2.
Отношение к кислотам. Обладая большой химической активностью, s -металлы подвергаются химическому растворению в воде. Только бериллий и магний не растворяются в воде при обычных условиях, поэтому имеет смысл говорить об отношении к кислотам только бериллия и магния. Имея низкие значения электродных потенциалов, эти металлы легко вытесняют водород из разбавленных кислот:
Mg + 2HCl → MgCl2 + H2.
В продуктах взаимодействия с разбавленной азотной кислотой значительную долю составляет нитрат аммония:
4Mg + 10HNO3 → 4Mg(NO3)2 + NH4NO3 +3H2O.
Гидроксиды щелочноземельных металлов – белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов (растворимость гидроксидов уменьшается с уменьшением порядкового номера элемента; Be(OH)2 – нерастворим в воде, растворяется в щелочах). Основные свойства гидроксидов увеличиваются с увеличением атомного номера: Be(OH)2 – амфотерный гидроксид, Mg(OH)2 – слабое основание, остальные гидроксиды – сильные основания (щелочи), проявляют все свойства щелочей: взаимодействуют с кислотными оксидами, кислотами, солями:
Ba(OH)2 + CO2 → BaCO3↓ + H2O
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Ba(OH)2 + K2SO4 → BaSO4↓+ 2KOH
Гидроксид бериллия взаимодействует со щелочами:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Соли. Соли s -металлов имеют ионную кристаллическую решетку. Cоли щелочных металлов обычно хорошо растворимы в воде. Мало растворимы соли лития: LiF, Li2CO3, Li3PO4. В отличие от солей щелочных металлов многие соли элементов II A группы малорастворимы. Из кислородсодержащих солей мало растворимы сульфаты, хроматы, фосфаты, карбонаты, оксалаты. Растворимость сульфатов и хроматов в рядах CaSO4 – SrSO4 – BaSO4 и CaCrO4 – SrCrO4 – BaCrO4 уменьшается.
Хорошо растворимы в воде хлориды, бромиды, иодиды, нитраты и ацетаты бериллия, магния, кальция, стронция, бария.
Лекция № 15. ХИМИЯ НЕКОТОРЫХ р- МЕТАЛЛОВ
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 1289; Нарушение авторских прав?; Мы поможем в написании вашей работы!