
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формирование знаний о основных геохимических циклах, приемах анализа параметров литосферы
|
|
|
|
Лекции
Учебно-методические материалы к дисциплине
ЛЕКЦИЯ № 1. Распространенность химических элементов (2 часа).
Цели.
2. способность организовывать сотрудничество обучающихся, поддерживать активность и инициативность, самостоятельность обучающихся, их творческие способности» (ПК-7)
3. Формирование знаний по оценке современного состояния отдельных геосфер или их частей, прогноза изменения их состояния в условиях антропогенного воздействия, разработки мероприятий по снижению уровня воздействия на геосферы или их составные части.
Содержание
Предмет химии окружающей среды. Связь с другими химическими науками. Происхождение химических элементов. Миграция элементов. Законы распространения элементов. Геохимические циклы основных элементов. Элементный состав почв. Органоминеральные соединения в почвах. Кларки. Энергетический и материальный баланс биосферы. Антропогенное воздействие на окружающую среду. Строение литосферы, примитивная литосфера, химический состав литосферы.
Работа с Интернет-источниками современные методы исследования внутреннего строения земли
История химических элементов, в течение которой сложились определенные пропорции количественных соотношений атомов, определила развитие планет Солнечной системы и нашей Земли. По своему составу (по плотности почти вдвое) внутренние планеты сильно отличаются от внешних. Основными источниками сведений о распространенности химических элементов служат данные о составе Солнца, полученные с помощью спектрального анализа, и результаты лабораторных химических анализов материала земной коры, метеоритов, пород поверхности Луны и планет. Свойства химических элементов, как известно, упорядочены в Периодическую таблицу элементов, и место элемента в таблице Менделеева определяется зарядом его ядра. Известные элементы характеризуются набором изотопов — атомов и тем же зарядом ядра, но с разными массами. Масса изотопа определяется суммой числа протонов и нейтронов в ядре и называется массовым числом. Вещество Земли и планет состоит из 300 изотопов, из которых 273 стабильны. Еще В.И.Вернадский подчеркивал, что в космических телах «распределение атомов зависит от строения их атомов».
Распространенность элементов с ростом порядкового номера убывает неравномерно, причем элементы с четным порядковым номером более распространены, чем с нечетным (в геологии этому соответствует правило Гаркинса—Оддо), особенно элементы с массовым числом, кратным 4, например Не, С, О, Ne, Mg, Si, S, Ar, Ca. На долю таких изотопов в земной коре приходится 86,81 % массы земной коры. Содержание элементов с четными порядковыми номерами составляет 60 % от числа всех.
Относительная распространенность химических элементов в Солнечной системе в зависимости от порядкового номера стабильных изотопов (рис. 1). Особенно резко эта закономерность проявляется в группе редкоземельных элементов. Эти элементы, имея одинаковое строение наружных электронных оболочек, обладают также близкими химическими свойствами. Ряд максимумов соответствует элементам с ядрами, у которых число протонов или нейтронов равно 2, 8, 20, 50, 82, 126. Этим «магическим» числам соответствуют заполненные ядерные оболочки, характеризующие устойчивые ядра.
Изотопы железа обладают относительно большой энергией связи на нуклон, и они энергетически устойчивы. Один из самых устойчивых изотопов железа — Fe-56 — наиболее распространен в космических телах. Академик А. Е. Ферсман отметил (1935), что в земной коре железо занимает четвертое место по массе и восьмое — по числу атомов, а в метеоритах — второе место по массе и четвертое — по числу атомов. Как отметили космохимики Г. Юри и Э. Зюсс, распространенность элементов и их изотопов определяется ядерными свойствами и что окружающее нас вещество похоже на золу космического ядерного пожара, в котором оно было создано. Большинство газов (или летучей части солнечного вещества) составляют Н, Не, СН4, СО, О, N, NH3, CO2 и все инертные газы. Основная часть внутренних планет и метеоритов состоит из нелетучих элементов солнечного вещества — Si, Fe, Vg, Ca, Al, Ni, Na. Сравнивая их, советский геохимик А. П. Виноградов показал (1962), что эти породообразующие элементы планет и метеоритов выброшены Солнцем, а не захвачены из других областей Галактики. Некоторые различия в составе планет связаны с вторичными процессами и с тем, что элементы входят в разные соединения, находясь в разных агрегатных состояниях. Особенно близок состав нелетучей части элементов Солнца и каменных метеоритов — хондритов. Летучая часть солнечного вещества, существующая в виде газов при Т > 0 °С, при низких температурах затвердевает, а атомы газов вступают в соединения. Инертные газы в соединения не вступают, оставаясь газами и при низких температурах. Земля и метеориты сохранили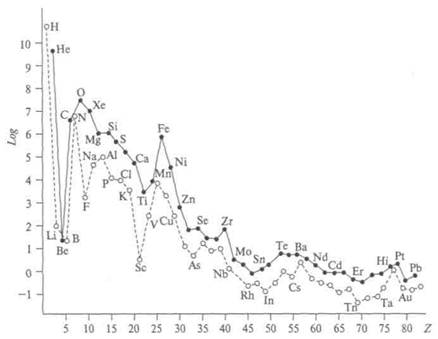
Рис. 1
летучие элементы в той степени, в какой они проявляли свою активность, и инертные газы в них редки. Изотопный состав элементов С, О, Si, Cl, Fe, Ni, Co, Ba, К, Сu одинаков на Земле и в метеоритах. Относительно Солнца таких широких исследований не проведено, но соотношение изотопов 12С/13С такое же, как и на Земле, и равно 0,011. Исследования инертных газов показали идентичность изотопного состава в Солнечной системе, тогда как на других звездах он другой. Все тела Солнечной системы построены из небольшого числа элементов (с 28-го номера распространенность резко падает) и имеют единое происхождение. Метеориты, большинство которых оказались очень древними, дали ценную научную информацию об истории возникновения отдельных тел Солнечной системы. По оценкам, основанным на законе радиоактивного распада урана, тория, рубидия и калия, их возраст около 4,5 — 4,6 млрд лет, т.е. совпадает с возрастом Земли и Луны. В них насчитываются примерно 66 минералов, большинство из них похожи на земные. Вероятно, метеориты образовались тогда же, когда и планеты земной группы. Кларки элементов:
| Номер п/п | Элемент | Кларк, масс.% |
| 1. | О | 49,5000 |
| 2. | Si | 25,8000 |
| 3. | Al | 7,5700 |
| 4. | Fe | 4,7000 |
| 5. | Ca | 3,3800 |
| 6. | Na | 2,6300 |
| 7. | К | 2,4100 |
| 8. | Mg | 1,9500 |
| 9. | H | 0,8800 |
| 10. | Ti | 0,4100 |
| 11. | Cl | 0,1900 |
| 12. | Р | 0,0900 |
| 13. | С | 0,0870 |
| 14. | Mn | 0,0850 |
| 15. | S | 0,0480 |
| 16. | N | 0,0300 |
| 17. | Rb | 0,0290 |
| 18. | F | 0,0280 |
| 19. | Ba | 0,0260 |
| 20. | Zr | 0,0210 |
| 21. | Cr | 0,0190 |
| 22. | Ni | 0,0150 |
| 23. | Sr | 0,0140 |
| 24. | V | 0,0140 |
| 25. | Zn | 0,0120 |
| 26. | Cu | 0,0100 |
| 27. | W | 0,0064 |
| 28. | Li | 0,0060 |
| 29. | Ce | 0,0043 |
| 30. | Co | 0,0037 |
| 31. | Sn | 0,0035 |
| 32. | Y | 0,0026 |
| 33. | Nd | 0,0022 |
| 34. | Nb | 0,0019 |
| 35. | Pb | 0,0018 |
| Итого | 99,98 масс.% | |
| Остальные элементы (в сумме) | 0,02 масс.% |
Преобладают элементы малых порядковых номеров: 15 наиболее распространённых элементов, кларки которых выше 100 г/т, обладают порядковыми номерами до 26 (Fe). Элементы с чётными порядковыми номерами слагают 87 % массы земной коры, а с нечётными — только 13 %. По геохимическим свойствам все элементы разделены на четыре группы по В.М. Гольдшмидту. Это разделение связано с определенной электронной структурой атомов, проявляющейся в смеси веществ при охлаждении и нагревании. Атмофильные элементы склонны накапливаться в атмосферах (это — все инертные газы, кислород, азот, водород); литофильные образуют твердые оболочки планет сродство к О, F,Cl плотность оксидов сравнительно не высока; халъкофильные создают соединения с серой, подобные ионам меди (от греч. «халькос» — медь) сродство к S,Se,Te; сидерофильные способны растворяться в сплавах железа (от греч. «сидерос» — железо) chjlcndj r C, P, As,Sb. Имеют большую плотность, встречаются в самородном состоянии.
Химический состав земной коры(рис.1), общая масса которой составляет только 0,5 % массы всей Земли, исследовали крупнейшие геохимики: Ф.Кларк, В.И.Вернадский, А.Е.Ферсман, А. П. Виноградов, супруги И. и В. Ноддак и др. Чтобы доказать наличие элемента рения в земной коре и определить его среднее содержание, супруги Ноддак провели 1600 анализов разнообразных минералов и пород. В литосфере наибольшее распространение сейчас получил кислород — 50 % массы всей литосферы; 26 % составляет кремний, 7 —8% — алюминий, 4% — железо; суммарное содержание магния, калия, кальция и натрия — порядка 10 %, а на долю оставшихся (более 80) элементов приходится несколько процентов.
Существенно, что кремний расположен в таблице Менделеева в том же столбце, что и важнейший элемент для живого вещества — углерод. Это подобие свойств отразилось и в истории биосферы. По одной из гипотез, первые формы живого вещества создавались на мокрых глинах. На основе окиси кремния образованы многие минералы, в том числе содержащие алюминий. По подсчетам Вернадского, земная кора (до глубин 16 км) состоит на 85 % из силикатов. Если в сложных алюминиево-кремниевых кислотах водород замещается металлами, то соли этих кислот — алюмосиликаты — становятся основой довольно сложных по составу минералов. Кристаллическую основу алюмосиликатов составляет замкнутая система атомов, содержащая алюмокислородные и кремнекислородные группы — комплексы. В зонах выветривания под действием внешних факторов (воды, солнечного излучения, газов) из них выносятся металлы и остается каолин (состав: кремний, алюминий, водород, вода или группа ОН). Эту конструкцию Вернадский назвал каолиновым ядром. Кольцевая структура ядра обеспечивает ему высокую устойчивость.
В составе атмосферы сейчас преобладают азот и кислород (98,6 % массы всей атмосферы), это соотношение практически неизменно до высот 150 км. Водорода почти в миллион раз меньше, чем кислорода. На высоте 160 км и выше состав атмосферы меняется и, как показали данные, полученные со спутников, водород становится преобладающим на высотах 1500 км.
В морской воде на долю кислорода, водорода, хлора и натрия приходится 99,5 %. Переход к гидросфере — это резкое изменение организации геосфер, вызванное переходом от плотных внутренних геосфер к значительно более подвижным внешним геосферам Земли.
Внутри Земли, по данным А.Е.Ферсмана, доля железа — 37 %, затем следуют кислород и кремний; более тяжелые элементы (около 0,5 % массы Земли) и элементы легче железа. Сравнение химического состава Земли и Солнца показывает, что относительное содержание элементов тяжелее натрия почти одинаково в атмосферах Земли и Солнца, содержание кислорода, углерода, азота, гелия в солнечной атмосфере в десятки раз больше, чем на Земле, а водорода — даже в 100000 раз. Радиоактивность — важнейшее свойство Земли, определяющее ее происхождение и химическую эволюцию. Первичные планеты были сильно радиоактивны, и, подвергаясь радиоактивному нагреву, они испытывали химическую дифференциацию, в результате которой у планет земной группы сформировались внутренние металлические ядра. Остатки металлической и сульфидно-металлической фаз, сохранившиеся в первичных мантиях, постепенно стекали к центру и формировали четкие границы ядер. Литофильные элементы переходили вверх, дегазация мантий при выплавлении легкоплавких фракций приводила к базальтовым расплавам, которые изливались на поверхности планет. Газовые компоненты, вырывавшиеся вместе с ними, дали начало первичным атмосферам, которые смогли удержать только крупные планеты. Наиболее массивная среди внутренних планет, Земля, прошла сложнейший путь химической эволюции. На последних стадиях остывания солнечной туманности возникли сложные органические соединения, обнаруженные в метеоритном веществе, которые были усвоены нашей планетой и привели к развитию жизни.
Самопроизвольный распад неустойчивых атомов отражает эволюцию вещества Земли и события эпохи рождения химических элементов, как устойчивых, так и неустойчивых. При распадах выделяется теплота Q. Для Земли сейчас важны радиоактивные изотопы урана, тория и калия, которые распадаются с выделением теплоты:
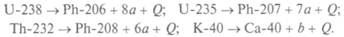
Тепловой баланс Земли определяется в основном теплотой, выделяемой при распаде этих изотопов. Для объяснения теплового режима земной коры достаточно имеющегося количества радиоактивных элементов в ее толще до глубин 0,9 м (по расчетам (1937) радиохимика академика В.Г.Хлопина). Алюмосиликатная кора Земли более радиоактивна, чем мантия. Считая равными в среднем радиоактивности планеты и метеоритов, можно оценить выделяемую Землей радиогенную теплоту от 9,66 1027 до 43,68 • 1027 Дж/год. Земля теряет теплоту в окружающее пространство путем излучения и теплопроводности. Геотермические измерения показали, что величина тепловых потоков одинакова и на дне океанов, и на материках: за год около 7,98 • 1027 Дж, что меньше количества радиогенной теплоты. По словам Вернадского, «количество создаваемой радиоактивным процессом тепловой энергии не только достаточно для того, чтобы объяснить потерю Землею тепла и все динамические и морфологические воздействия внутренней энергии планеты на ее поверхность — земную кору, но и для того, чтобы поднять ее температуру». В конце 50-х гг. обнаружили, что верхние слои атмосферы излучают избыточную энергию в инфракрасном диапазоне. Это связано с взаимодействием атмосферных газов с коротковолновым излучением Солнца, существенно влияющими на погоду.
Сверхглубокая скважина, пробуренная на Кольском полуострове, позволила проникнуть в недра Земли на глубину 12 км и получить непосредственные данные о составе и условиях внутри Земли. Давление в земных недрах растет с глубиной, причем при глубине 3 км — резко растет, а при глубине 8 км — резко падает. Температура из-за приближения к мантии тоже растет, сначала на 1 °С каждые 100 м (до глубины 3 км), затем по 2,5 °С, а на глубине 10 км достигает 180 °С. Пробуренные толщи Земли показывают, что в этих областях идут активные процессы рудообразования, на глубине 4—11 км обнаружены крупные зоны раздробленных пород, образованных при относительно низких температурах и сцементированных сульфидами Fe, Ni, Co, Си. К настоящему времени определены горизонты, на которых преимущественно находятся те или иные важные для жизни полезные ископаемые. Так, благородные металлы чаще всего находятся на глубинах 300 — 800 м, цветные металлы — 600—1200 м, железные руды — 300 — 2000 м, каменный уголь — 700 — 1500 м, нефть и газ — 2500 — 6000 м. Процесс формирования полезных ископаемых тесно связан с историей планеты.
Из законов радиоактивного распада следует, что в прошлом радиоактивность была выше. Так, 4,5 млрд лет назад урана-238 на Земле было вдвое больше, чем сейчас, и энергии он выделял больше. Высокая радиоактивность ранней Земли повышала ее температуру, способствовала плавлению веществ и была ведущим фактором химической дифференциации. Кроме тория, урана и калия существовали радиоактивные изотопы с периодом полураспада менее 108 лет. Они возникли в эпоху ядерного синтеза тяжелых элементов и вошли в состав молодых тел Солнечной системы. Примером может служить йод-129 с периодом полураспада 17,2 млн лет, превращающийся в ксенон-129.
В докембрийском редкоземельном минерале бастиезите обнаружены (1971) долгоживущие радиоактивные элементы плутоний-244 и кюрий-247, имеющие своим конечным продуктом распада ксенон-131 —136. Значит, при «варке» тяжелых элементов были и сверхтяжелые трансурановые ядра, пока не полученные в лаборатории (так как с ростом номера элемента неустойчивость трансурановых ядер резко растет). Группа индийских ученых во главе с С. Бандари обнаружила в некоторых метеоритах и лунной пыли следы более 300 треков, которые могли быть вызваны такими трансурановыми элементами, присутствовавшими при затвердевании породы. Большинство «вымерших» радиоактивных изотопов при распаде выделяли много больше энергии. Так, если при распаде урана выделяется 2,98 Дж/год, то плутония-244 — 50,5 Дж, кюрия-247 — 160,3 Дж и йода-129 — 5,54 Дж/год.
Все земные геосферы связаны между собой кругооборотами вещества, глобальными потоками энергии и момента импульса. В результате образуется сложная система, состояние которой, во многом похожее на состояние динамического равновесия, создает условия для динамической эволюции планеты. Для всех геосфер характерны многочисленные и закономерные отклонения от однородного (симметричного) состояния, наличие градиентов температур, давлений, потенциалов и т.д., которые и направляют потоки вещества, энергии и информации. Хотя каждая из геосфер имеет свою специфику динамики, обменов, систем обратных связей, многие особенности регулируются взаимодействиями между этими огромными подсистемами. В. И. Вернадский описал минералы и их жизнь, природные геологические тела, в которые соединяются минералы, а также сферы Земли, составленные из этих сфер. Эти знания необходимы в поиске месторождений полезных ископаемых. Совместное рождение минералов, образующих природные тела, называют парагенезисом. Парагенезис минералов мало менялся на обозримых промежутках времени, но глобальные изменения условий на нем отразились. Например, оловянный камень (каситерит) накапливался в наибольших количествах в древнем архее и в третичный период. Вернадский, изучавший геологическую историю, насчитывающую многие миллионы лет и огромные пространственные области Земли, писал: «Все реакции земной коры, насколько их можно проследить до сих пор, представляют собой определенные циклы, определенные круговые системы химических изменений, которые постоянно вновь повторяются».
Как известно, природные химические элементы занимают в Периодической таблице места до № 92, т. е. до урана. Более тяжелых элементов нет ни на Земле, ни в метеоритах, приходящих из Космоса. Это и понятно — в ядрах атомов этих элементов больше протонов, значит, ядра таких элементов неустойчивы, а атомы — радиоактивны. Для получения трансурановых элементов были созданы специальные установки, названные циклотронами, в которых создаются мощные пучки а-частиц и более тяжелых частиц для бомбардировки ими урана. Первые циклотроны были созданы в США, где были получены сначала плутоний и нептуний, а затем — вплоть до элемента № 101. В нашей стране получением трансурановых элементов занялась группа ученых во главе с Г.Н.Флеровым. В подмосковном городе Дубна был введен в строй более совершенный циклотрон, в котором разгонялись ядра атомов легких элементов. В начале 60-х гг. шведы, а затем американцы сообщили о получении элемента № 102 с атомной массой 254, названного нобелием. Но в 1963 г. группа Флерова получила элемент № 102 с атомной массой 256, а многочисленные трехлетние исследования показали, что изотопа с массой 254 у этого элемента нет, т.е. сообщение шведов и американцев — фальсификация, и элемент № 102 стал первым элементом, полученным в СССР. Исследовать его свойства было очень трудно, так как его атомы распадаются за несколько секунд, и изучить свойства нужно всего по нескольким атомам. Но с помощью сверхчувствительного метода газовой радиохимии, разработанного в Дубне, эта задача была блестяще решена. Новый элемент обладал химическими свойствами, соответствующими актинидам (3-я группа Периодической таблицы), и советские ученые предложили назвать его в честь Фредерика Жолио-Кюри.
Понятие о почве, ее функции
Одним из важнейших компонентов литосферы является почва (педосфера). Ее значение весьма велико. Современное почвоведение рассматривает почву не только как особое естественноисторическое тело, обладающее плодородием, но и как полифункциональную природную систему, обеспечивающую циклический характер воспроизводства жизни на суше.
Почву можно рассматривать как планетарный механизм, который благодаря сложной системе равновесий регулирует глобальные циклические процессы массообмена химических элементов.
Многочисленные функции почвы можно разделить на экосистемные и биосферные. Экосистемными являются физические, химические, биологические и информационные.
Экологические функции почв, имеющие отношение к их химическим и физико-химическим свойствам, обеспечивают поглотительную способность почв, возможность деструкции и минерализации органических остатков растений и животных, аккумуляцию биофильных элементов.
Биосферные функции почв свидетельствуют об их исключительно важной роли в биосфере и жизни человека. В начале XX в. В.И. Вернадский отметил, что «все яснее становится нам значение почвы в биосфере - не только как субстрата, на котором живет растительный и животный мир, но как области биосферы, где наиболее интенсивно идут разнообразные химические реакции, связанные с живым веществом».
Важнейшим компонентом почвы является гумус. Гумус - органическое вещество почвы, образующееся в результате разложения растительных и животных остатков и продуктов жизнедеятельности организмов.
Суммарные запасы гумуса во всей педосфере оцениваются в приблизительно в 2,5- 1012 т. В зависимости от биоклиматических условий в разных районах Мировой суши (за исключением территории, покрытой ледниками, и абсолютных пустынь) поступление мертвого органического вещества колеблется от 1,0 до 25,0 т/км2 в год. Суммарная масса ежегодно отмирающего органического вещества (с учетом сокращения природной растительности человеком) близка к 125·106-130·106 т.
Основными компонентами гумуса являются гуминовые кислоты и и фульвокислоты, их соли, а также гумин - своеобразный комплекс гумусовых кислот, связанных с высокодисперсными минеральными частицами.
Гуминовые кислоты нерастворимы в воде, но растворимы в щелочах, имеют бурый или черный цвет, благодаря высокой клеящей способности создают структуру почв. Гуминовая кислота - темноокрашенная фракция органических веществ, экстрагируется из почвы щелочными растворами и осаждается минеральными кислотами при рН -1-2, имеет переменный состав (С от 48 до 64%; Н - 3,4-5,6; N - 2,7-5,3%).
Основными структурными единицами молекулы гуминовой кислоты являются сконденсированная центральная часть (ядро), боковые цепи и периферические функциональные группы: карбоксильные (-СООН), фенол гидроксильные (-ОН), метоксильные (-ОСН3), карбонильные (-С=0). Ядро состоит из сконденсированных ароматических и гетероциклических кольцевых соединений, боковые цепи - из углеводных, аминокислотных и других групп. Реакционная способность гуминовых кислот связана с карбоксильными и фенол гид-роксильными группами, водород которых может замещаться катионами. В почве обычно присутствуют не свободные гуминовые кислоты, а их соли - гуматы кальция, магния и др. Часть водорода функциональных групп замещается комплексными катионами типа [Fe(OH)2]+ и других металлов. В результате образуются сложные внутрикомплексные соединения - хелаты железа, алюминия и т.д.
Фульвокислоты растворяются в воде, растворы их имеют сильнокислую реакцию (рН 2,6-2,8), в высушенном состоянии имеют желтый цвет, активно воздействуют на различные минералы, разрушая их и образуя устойчивые комплексные соединения с катионами. Фульвокислоты - специфические органические оксикарбоновые кислоты, растворимые в минеральных кислотах, содержат углеводы, характеризуются пониженным по сравнению с гуминовыми кислотами содержанием углерода и азота (содержание С - 40-45%, N - 3-4,5%).
Содержание фульвокислот в почве уменьшается с увеличением массы гумуса, а содержание гуминовых кислот, наоборот, увеличивается. Поэтому для характеристики органической части почвы важное значение имеет соотношение между содержанием гуминовых кислот и фульвокислот или соотношение углерода гуминовых и фульвокислот.
Хорошая растворимость фульвокислот по сравнению с гуминовыми кислотами является причиной их более высоких концентраций и распространения в поверхностных водах. Содержание фульвокислот, как правило, превышает содержание гуминовых кислот в
10 раз и более. Растворяющая способность фульвокислот усиливается их склонностью к хелатированию. Комплексные соединения фульвокислот могут активно мигрировать в природных водах в таких физико- химических условиях, в которых свободные катионы металлов выпадают в осадок.
Гумин - часть гумусовых веществ, которая не растворяется ни в одном растворителе. В составе фульвокислот идентифицируются различные, хорошо известные в органической химии соединения. Как правило, это низкомолекулярные вещества типа аминокислот, моносахаров, предельных углеводородов, кислот и т.п. Небольшая часть фульвокислот представлена гуминоподобными продуктами, происхождение которых вполне может быть обусловлено гидролизом гуминовых кислот и гумина.
Определение возраста по радиоактивному изотопу углерода гуминовых кислот показало их существование сотни и тысячи лет.
Биогеохимическая роль гумуса (биогеохимические циклы)
Распространение наземных живых организмов способствовало формированию биогеохимической структуры на суше. Возникновение почвы как биолатентного тела отражало специфическую фазу развития живой материи на Земле, одним из основных признаков которой было все усиливающееся возобновление живой массы во всех доступных экологических нишах. Почвенная органическая масса играет важную роль в формировании почвенного гумуса. С одной стороны, гумус - источник азота и других питательных элементов, необходимых для роста всех высших растений. Эти питательные вещества высвобождаются при минерализации гумуса под воздействием микробов. Гумус определяет почвенное плодородие и продуктивность растений. Гумусовые кислоты и их производные, обладая огромной поглотительной способностью, оказывают активное воздействие на процессы миграции и аккумуляции элементов в биогеохимических циклах. Поверхность гумусовых веществ достигает 800- 900 м2/г, что позволяет адсорбировать около 1,50-3,00 мг-экв/г элемента..
Состав почвенной органической массы обычно классифицируется по степени её растворимости в кислотах и щелочах и фракционируется как:
- гуминовые кислоты (ГК), растворимые в основаниях, но осаждаемые при подкислении щелочного раствора до рН=2;
- фульвокислоты (ФК), растворимые как в щелочах, так и кислотах;
- гумин как нерастворимый в кислотах и щелочах остаток.
Будучи структурно схожими, фракции гумуса различаются по молекулярному весу и химическому составу.
Фульвокислоты кислоты содержат меньше Н, N и S, но больше О, чем гуминовые кислоты и гумин.
В биогеохимических процессах наибольший интерес представляют водорастворимые фульвокислоты и низкомолекулярные гуминовые кислоты, которые играют важную роль в природном выветривании горных пород. Эти соединения ускоряют выветривание через процессы комплексообразования, растворения и транспорта исходных геологических материалов. Биогеохимическая трансформация органического вещества в почвах не сводится только к формированию гумуса. Под воздействием микробов происходит также полное разрушение органических веществ с выделением СО2, как конечного процесса. С использованием 14С изотопа показано, что обновление гумуса в верхних горизонтах современных почв происходит за 300-500 лет. В нижних горизонтах почв процессы обновления гумуса идут намного медленнее и возраст органической массы может составлять несколько тысяч лет.
Химический состав минералогической части почв - это общее содержание всех макроэлементов почв. Он существенно отличается от валового содержания элементов в литосфере (табл. 1).
Таблица 1.
Среднее содержание химических элементов в литосфере и в почвах (в % по массе)
| Элементы | Литосфера | Почва | Элементы | Литосфера | Почва |
| O | 47,20 | 49,0 | N | 0,01 | 0,10 |
| Si | 27,60 | 33,0 | Ti | 0,60 | 0,46 |
| Al | 8,80 | 7,1 | H | 0,15 | |
| Fe | 5,10 | 3,8 | C | 0,10 | 2,00 |
| Ca | 3,60 | 1,4 | S | 0,09 | 0,085 |
| Na | 2,6 | 0,6 | Mn | 0,09 | 0,085 |
| K | 2,6 | 1,4 | P | 0,08 | 0,08 |
| Mg | 2,10 | 0,60 | Cu | 0,01 | 0,002 |
Из таблицы следует, что литосфера в основном состоит из 8 элементов, в почве значимы также С, Р и N, что обусловлено влиянием биогенных факторов.
Поскольку основная часть почвенной массы представлена минеральными частицами, валовой химический состав почвы в преобладающей мере определяется составом количественным соотношением формирующих ее минералов. Поэтому в валовом химическом составе почв преобладают О и Si, в меньшей мере Al и далее по убывающей Fe, Са, Na, К, Mg. Другие элементы присутствуют в микроколичествах.
Плодородие определяется химическим поглощением почвы. Химическая поглотительная способность — это способность почвы удерживать некоторые ионы путем образования в результате химических реакций нерастворимых или труднорастворимых в воде соединений.
Анионы азотной и соляной кислот (NO3- и С1-) ни с одним из катионов (Са2-+, Mg2+, K+, А13+, NH4+) не образуют в воде труднорастворимых соединений, т.е. химически почвой не поглощаются.
Анионы угольной и серной кислот (СО32-, SO42-) в почвах с большим
количеством Са2+, Mg2+ химически поглощаются, так как образуют с
ними труднорастворимые в воде соединения. Химическое поглощение
фосфорной кислоты в почве происходит при образовании труднорастворимых или нерастворимых солей с двухвалентными и трехвалентными
катионами (Са2+, Mg2+, Fe3+, Al3+).
В почвах с нейтральной или слабощелочной реакцией, содержащих обменно поглощенный кальций, бикарбонаты кальция или магния в почвенном растворе, химическое закрепление фосфорной кислоты происходит в результате образования слаборастворимых фосфатов кальция и магния, малорастворимые соли осаждаются и переходят из почвенного раствора в твердую фазу почвы. Поэтому такого типа процессы называют химическим поглощением. Если почвенный раствор имеет кислую реакцию, то образование нерастворимого в воде фосфата кальция затрудняется. Наоборот, при взаимодействии кислого раствора с твердой фазой, содержащей СаНРО4 или Са3(РО4)2, возникают процессы, прямо противоположные химическому поглощению, а именно процессы растворения. Подкисление может происходить в результате выделения углекислоты корнями растений и микроорганизмами, или в результате образования азотной кислоты в процессе нитрификации. Но в кислой среде могут образовываться и малорастворимые соли фосфорной кислоты при ее взаимодействии с гидратом окиси железа или гидратом окиси алюминия:
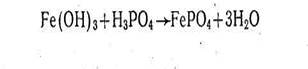
|
Образовавшиеся соли в отличие от фосфатов кальция мало растворимы в почвенном растворе с кислой реакцией среды. Поэтому в зависимости от реакции среды химическое поглощение фосфорной кислоты, в почвах происходит по-разному. В почвах с кислой реакцией преимущественно образуются малорастворимые фосфаты полуторных окислов, а в почвах с нейтральной и щелочной реакцией химическое поглощение фосфорной кислоты может быть связано с образованием малорастворимых фосфатов кальция.
В результате химического поглощения фосфор фосфорных удобрений переходит в менее доступную для растений форму. По возрастающей интенсивности химического поглощения фосфорной кислоты почвы располагаются в такой последовательности: чернозем<серозем<дерново-подзолистые почвы<красноземы.
Физико-химическое, или обменное, поглощение катионов — это способность мелкодисперсных коллоидов частиц почвы, как минеральных, так и органических, несущих отрицательный заряд, поглощать различные катионы из раствора.
Обменное поглощение состоит в том, что из раствора в твердую фазу переходят одни катионы, а одновременно из твердой фазы в раствор вытесняется соответствующее количество другого катиона, который до этого находился в почве в поглощенном состоянии.
К. К. Гедройц сформулировал Основной закон, управляющий обменной адсорбцией почв: все почвы обладают способностью обменивать содержащиеся в их поглощающем комплексе поглощенные катионы (как металлические, так и водородные) на любые катионы электролитов (как металлические, так и водородные), причем количество катионов, поглощенное почвой, эквивалентно количеству катионов, вытесненных из почвы в раствор.
В обменном поглощении катионов, как и при физической поглотительной способности почв, существенную роль играет поверхностная энергия. Однако если при физическом поглощении процесс ограничивается положительной или отрицательной концентрацией растворенного в слое жидкости у поверхности почвенных частиц, то при обменном поглощении электролиты почвенного раствора вступают в химическую реакцию с молекулами, расположенными на поверхности почвенных частиц; такая химическая реакция возможна, с одной стороны, при наличии поверхностной энергии, а с другой стороны, заряженные отрицательно почвенные коллоидальные частицы притягивают к своей поверхности катионы электролитов почвенного раствора, где эти катионы и вступают в реакцию обмена с катионами молекул, расположенных на поверхности частичек. Эти обменные реакции имеют двойственную природу — физическую и химическую. Поэтому и поглотительная способность почв названа физико-химической.
Важно отметить, что в отличие от химического поглощения (когда вследствие образования нерастворимых соединений изменяется состав и общая концентрация раствора) при обменном поглощении концентрация раствора не изменяется, но изменяется вследствие обмена состав катионов в растворе, а концентрация анионов почти не изменяется. При поглощении какого-либо катиона из раствора почва одновременно отдает в раствор эквивалентное количество, другого катиона, который раньше находился в твердой фазе:
(почва) Са + 2NH4NO3 = >(почва)2 NH4 + Са (NO3)2
Реакция обмена катионов обратима. Поэтому реакцию обменного поглощения катионов правильнее изображать
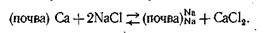
В зависимости от концентрации раствора, его объема, природы обменивающихся катионов и свойств адсорбирующих частиц почвы между катионами раствора и поглощенными катионами раствора почвы устанавливается некоторое подвижное равновесие. Изменение состава почвенного раствора при внесении удобрения, образование растворимых соединений в результате деятельности микроорганизмов в почве, выделение СО2 и других веществ корнями высших растений — все эти факторы смещают подвижное равновесие между твердой фазой почвы и почвенным раствором и вызывают переход одних катионов из раствора в поглощенное состояние и других из поглощенного состояния в почвенный раствор. Обменное поглощение в почвах впервые было глубоко и всесторонне исследовано советским ученым К. К. Гедройцем. Всю совокупность мелко дисперсных почвенных частиц (минеральных и органических) Гедройц предложил называть почвенным поглощающим комплексом.
В состав его входят почвенные коллоиды, частицы
меньше 0,00025 и до 0,001 мм. Последние обладают значительно меньшей способностью к обменному поглощению. Почвенные коллоиды
подразделяются на органические, минеральные и органо-минеральные (последние слабо изучены).
Органические коллоиды представлены в основном гумусовыми веществами (гуминовые кислоты, фульвокислоты и их соли).
В состав минеральных коллоидов входят кристаллические глинистые минералы каолинитовой и монтмориллонитовой групп, гидрослюды,
а также аморфные соединения — гидраты полуторных окислов, кремниевая кислота и др. Все органические и минеральные коллоиды имеют отрицательный заряд, за исключением коллоидов гидроокисей алюминия и железа, заряженных положительно. Этим объясняется ярко выраженная способность большинства почв к поглощению катионов, а не анионов. Глинистые минералы каолинитовой группы при кислой
реакции также могут приобретать положительные заряды.
Гидроксильные ионы, связанные с алюминием в октаэдрическом слое, расположенном на внешней поверхности микрокристаллических частиц каолинита, при кислой реакции, т. е. при избытке в растворе ионов водорода, могут отщепляться, в результате чего на отдельных участках коллоидной частицы возникают положительные заряды. Основные свойства таких коллоидов могут проявляться на сильнокислых дерново-подзолистых почвах и красноземах.
Следовательно, у минералов каолинитовой группы при кислой реакции могут быть на разных участках одновременно положительный и отрицательный заряды. В этом случае они способны к поглощению из почвенного раствора анионов в обмен на ОН-. Поэтому чем больше в поглощающем комплексе почвы минералов этой группы, а также гидроокисей алюминия и железа, тем ниже способность к обменному поглощению катионов, а способность к обменному поглощению анионов возрастает.
Обменное поглощение катионов имеет свои закономерности.
1. Реакция обмена протекает в эквивалентных соотношениях и обратима. При этом устанавливается подвижное равновесие между почвой и раствором.
2. При постоянной концентрации раствора количество катионов, вытесняемых из почвы в раствор, возрастает с увеличением объема раствора, а при постоянном объеме раствора количество катионов, вытесняемых из почвы в раствор, повышается с увеличением концентрации раствора вытесняющей соли.
3. Реакция обмена катионов протекает с большой скоростью, равновесие устанавливается в течение нескольких минут.
4. Разные катионы с неодинаковой энергией поглощаются почвой и удерживаются в поглощенном состоянии.
В общем, чем выше относительная атомная масса и чем больше заряд катиона, тем сильнее он поглощается и труднее вытесняется из поглощенного состояния другим катионом. Например, в ряду одновалентных катионов поглощение возрастает в следующем порядке: Li<Na<NH4<K<Rb с относительной атомной массой соответственно 6, 9, 23, 18, 39, 85. Двухвалентные катионы располагаются в ряд Mg<Ca<Co (относительная атомная масса соответственно 24, 40, 59), а трехвалентные — Al<Fe (относительная атомная масса 27 и 56).
Вместе с тем двухзарядные катионы магния поглощаются сильнее однозарядных катионов натрия, кальций поглощается сильнее калия и т. д. (при одинаковых, примерно относительных атомных массах). Для характеристики неодинаковой сорбируемости различных катионов К. К. Гедройц ввел понятие «энергия поглощения катионов».
Ионы водорода, несмотря на наименьшую относительную атомную массу, обладают высокой способностью вытеснять другие катионы из поглощенного состояния. Энергия поглощения его в 4 раза больше, чем у кальция, ив 17 раз больше, чем у натрия.
Возрастание энергии поглощения катионов с увеличением их атомной массы объясняется тем, что с ростом атомной массы и размера катиона уменьшается их степень гидратации. Слабо гидратированные катионы сильнее притягиваются поверхностью коллоида. Необходимо также отметить, что минералы группы каолинита поглощают катионы только наружной поверхностью кристалла, так как они имеют незначительное свободное пространство между пакетами кристаллической решетки (2,8 А). У минералов же группы монтмориллонита свободное пространство между пакетами значительно больше (в сухом состоянии 9,4 А, при набухании возрастает до 21 А), что делает возможным проникновение в это пространство даже сравнительно крупных ионов.
В почве происходит и необменное поглощение катионов,, в результате чего глинистыми минералами (мусковитом, вермикулитом, иллитом, монтмориллонитом), имеющими трехслойную кристаллическую решетку, которая может расширяться, закрепляются катионы (калия, аммония, цезия, рубидия). Предполагается, что катионы попадают в межпакетные пространства кристаллической решетки этих минералов.
Необменное поглощение аммония и калия изменяется в очень широких пределах, в зависимости от генетических особенностей почв, их механического и минералогического состава. У черноземов оно выражено значительно сильнее, чем у дерново-подзолистых почв. Возрастает оно также при попеременном увлажнении и высушивании почв. Поэтому неглубокая заделка аммиачных и калийных солей в слои почвы, подверженной попеременному увлажнению и высушиванию, усиливает необменное поглощение аммония и калия, внесенных с удобрениями. Необменно поглощенные почвой аммоний и калий медленнее освобождаются в доступные растениям формы, чем обменно поглощенные.
Емкость поглощения. Общее количество катионов, которое почва способна удерживать в обменном состоянии, содержащееся в 100 г почвы, называется емкостью поглощения. Емкость поглощения удобнее всего выражать в миллиэквивалентах на 100 г почвы. Если, например, 100 г почвы содержат 500 мг поглощенного кальция (и больше никаких других катионов), то емкость поглощения такой почвы равна 500:20 = 25 мэкв/100 г почвы (эквивалентная масса кальция 40:2 = 20, поэтому 1 мэкв кальция равен 20 мг Са). Если весь кальций (500 мг) вытеснить NH4C1, то вместо кальция поглотится 450 мг NH4, и почва будет содержать 450 мг поглощенного аммония (эквивалент NH4=18). Поэтому при обмене Са на NH4 на место 20 мг Са будет поглощено 18 мг аммония. Емкость же поглощения остается одинаковой; если выразить ее в миллиэквивалентах, то она опять будет равна 25 мэкв/100 г почвы, так как 450:18 = 25, т. е. емкость поглощения для конкретной почвы — величина постоянная.
Величина емкости поглощения определяется рядом факторов: 1) содержанием высокодисперсных частиц в почве; 2) химическим и минералогическим составом почвенных коллоидов; 3) реакцией почвы (величиной рН). Почвы, содержащие в большом количестве высокодисперсные частицы, отличаются высокой емкостью поглощения; емкость поглощения катионов у глинистых почв выше, чем у песчаных.
Разные группы почвенных коллоидов резко отличаются по емкости поглощения. Из глинистых минералов наибольшей емкостью поглощения обладают минералы группы монтмориллонита. Эти минералы характеризуются высокой степенью дисперсности, соответственно этому емкость поглощения катионов у монтмориллонита сравнительно велика— 60—150 мэкв/100 г минерала. Каолинит отличается малой дисперсностью и небольшой активной поверхностью. Соответственно невысока и его емкость поглощения катионов — всего 3—15 мэкв/100 г минерала.
Органические почвенные коллоиды — гумусовые вещества—обладают значительно большей поглотительной способностью по сравнению
с минеральными. Отличия в емкости обмена катионов гуминовыми кислотами различного происхождения определяются разным содержанием
функциональных групп: гуминовые кислоты подзолистых почв имеют
емкость обмена около 350 мэкв/100 г вещества (при рН 7,0), а у гуминовых кислот чернозема и каштановых почв при тех же условиях — 400—
500 мэкв/100 г. Поэтому черноземы имеют более высокую величину ем
кости поглощения (40—60 мэкв/100 г почвы) по сравнению с дерново-
подзолистыми почвами (10—15 мэкв/100 г). Емкость поглощения
третьей группы высокодисперсных почвенных частиц—аморфных минеральных коллоидов — зависит от соотношения в их составе SiO2: R2O3.
Чем шире это отношение, чем больше ацидоидная часть, тем выше и
величина емкости поглощения ими катионов. С повышением рН увеличивается и емкость поглощения, так как возрастает отрицательный заряд коллоидов и, следовательно, поглотительная способность по отношению к катионам.
Обменная поглотительная способность зависит от состава почвенных коллоидов. Чем больше в составе мелкодисперсной, фракции почвы неорганического вещества и минералов глин монтмориллонитовой группы, тем выше бывает емкость поглощения. Способность органического вещества почвы к адсорбции катионов обусловлена кислотной (ацидоидной) природой перегнойных веществ, благодаря которой органические.почвенные коллоиды имеют отрицательный заряд. Отрицательный заряд органическим коллоидам сообщают карбоксильные группы по такой схеме: R COOH =R COO-+H+. Реакцию обмена катионов, поглощенных органическими почвенными коллоидами, можно представить следующим образом:
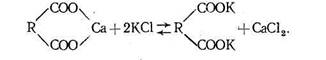
Способность к обмену катионов у минеральных частиц мелкодисперсной фракции почв также связана с отрицательным зарядом.
Возникновение отрицательного заряда у почвенных минералов связано главным образом с наличием изоморфных замещений в силикатных и алюмосиликатных структурах (например, кремния на алюминий и др.), что можно объяснить следующим образом. Соединение состава (SiO2)n нейтрально, но если в кремнекислородной структуре некоторая часть атомов кремния в тетраэдрической координации замещена на атомы алюминия, то такое замещение нарушает нейтральность и сообщает алюмосиликатному образованию отрицательный заряд. Схематически это можно представить так:
Отрицательный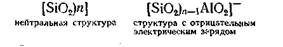 заряд в алюмосиликатах уравновешивается соответственным количеством таких катионов, как К+, Na+, Ca2+ и др. У минералов глин, входящих в состав мелкодисперсной фракции почвы, эти катионы оказываются способными к диссоциации и обмену на другие катионы по схеме
заряд в алюмосиликатах уравновешивается соответственным количеством таких катионов, как К+, Na+, Ca2+ и др. У минералов глин, входящих в состав мелкодисперсной фракции почвы, эти катионы оказываются способными к диссоциации и обмену на другие катионы по схеме
Приведенная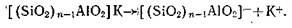 схема показывает, почему именно алюмосиликаты, а не свободная SiO2 оказываются носителями обменной поглотительной способности минеральной части почвы. Алюминий, входящий в состав кремнекислородной (тетраэдрической) структуры, замещающий в ней частично кремний, сообщает этой структуре кислотные свойства, которыми чистая SiO2 не обладает.
схема показывает, почему именно алюмосиликаты, а не свободная SiO2 оказываются носителями обменной поглотительной способности минеральной части почвы. Алюминий, входящий в состав кремнекислородной (тетраэдрической) структуры, замещающий в ней частично кремний, сообщает этой структуре кислотные свойства, которыми чистая SiO2 не обладает.
Среди почвенных минералов наиболее высокой обменной способностью, обусловленной указанными причинами, обладает монтмориллонит. Решетка монтмориллонита состоит из множества плоских пакетов, состав и строение которых схематически можно представить так
Такая структура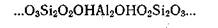 нейтральна, алюминий (в центральной части пакета) образует в ней слой с октаэдрической координацией, и в этом положении отрицательного заряда алюмосиликатной структуре он не сообщает. Однако заряд появляется, если алюминий частично заместит кремний в кремнекислородном слое, например:
нейтральна, алюминий (в центральной части пакета) образует в ней слой с октаэдрической координацией, и в этом положении отрицательного заряда алюмосиликатной структуре он не сообщает. Однако заряд появляется, если алюминий частично заместит кремний в кремнекислородном слое, например:
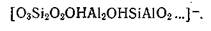
Таким образом, влияние алюминия на заряд алюмосиликатной структуры связано с его положением в ней. Алюминий, образующий самостоятельный алюмокислородный или алюмогидроксильный слой с октаэдрической координацией, ацидоидными свойствами не обладает. Кроме частичного замещения кремния на алюминий у монтмориллонита причиной появления отрицательного заряда бывают и другие изоморфные замещения, например частичная замена алюминия в октаэдрической координации на магний:
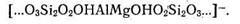
Высокообменная способность минералов данного типа обусловлена также тем, что обмен катионов у них не ограничивается внешней поверхностью микрокристаллических частиц, но распространяется внутрь их вследствие того, что при набухании раствор проникает в межпакетные промежутки кристаллической решетки микрокристаллов.
Другие минералы мелкодисперсной фракции почвы имеют более плотную упаковку, и поэтому обмен катионов происходит у них только на внешней поверхности микрокристаллов. К таким относятся, в частности, минералы группы каолинита, состав и строение пакетов которого можно представить так:
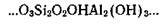
По сравнению с минералами монтмориллонитовой группы каолинит отличается более высоким содержанием алюминия и меньшим — кремнекислоты. Алюминий в такой структуре не только не сообщает ацидоидных свойств минералу, а, наоборот, может проявить свои основные свойства за счет связанных с алюминием гидроксильных ионов выходящих на внешнюю поверхность микрокристаллических частиц:
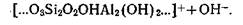
Еще в большей степени проявляются основные (базоидные) свойства у свободных, не связанных с кремнекислотой полуторных окислов (алюминия и железа), которые в кислой среде реагируют преимущественно как основания:
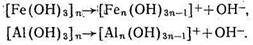
По мере общего увеличения в составе мелкодисперсной фракции почв содержания алюминия и железа и уменьшения количества кремне-кислоты наблюдаются, как правило, снижение способности к обмену катионов, уменьшение емкости поглощения.
Таким образом, емкость поглощения почвы зависит__не только от общего содержания мелкодисперсной, коллоидной фракции, но и от химического состава и связанного с ним строения адсорбирующих частиц. Малая, емкость поглощения у_легких песчаных_и бедных органическим веществом почв, объясняется малым содержанием мелкодисперсной коллоидной фракции. Невысокая емкость поглощения дерново-подзолистых почв может быть обусловлена повышенным содержанием в мелкодисперсной фракции свободных полуторных окислов, - среди алюмосиликатных минералов — глин с преобладанием структур типа каолина. Высокая емкость поглощения у почв черноземного типа обусловлена как повышенным содержанием у них тонкодисперсной фракции с большой долей органических веществ в ее составе, так и преобладанием среди минералов глин минтмориллонита отношением S1O2:(Аl2Оз+Fе2Оз). На емкость поглощения влияет также реакция среды. Как органические, так и большинство минеральных почвенных коллоидов, обладающих ацидоидными свойствами, проявляют их в большей степени в условиях нейтральной и слабощелочной среды. При кислой реакции, наоборот, заряд почвенных коллоидов уменьшается, в результате чего емкость поглощения катионов несколько снижается.
Состав поглощенных катионов. Большая часть емкости поглощения черноземных почв, как правило, занята кальцием (30—40 мэкв) и магнием (5—10 мэкв). В поглощающем комплексе солонцовых и засоленных почв (солонцах, солончаках) кроме кальция и магния содержатся катионы натрия, а подзолистых и латеритных — ионы алюминия и водорода.
Состав поглощенных катионов оказывает на свойства почвы определенное влияние.
1. Вследствие обратимости реакции обмена катионов почва обладает способностью регулировать состав почвенного раствора (КС1 на черноземе вытесняет Са, а на кислых почвах — А1 и Н). Состав поглощенных катионов, может оказать существенное влияние на действие удобрений.
2. Состав поглощенных катионов влияет на состояние самого поглощающего комплекса, (кальций и магний увеличивают емкость поглощения, улучшают физические свойства почвы, натрий ухудшает их).
Ионы водорода создают кислотность почвы и вызывают постепенное разрушение минералов, входящих в состав поглощающего комплекса почвы. Поэтому вытеснение поглощенного кальция водородом приводит к уменьшению емкости поглощения, что также ухудшает структур почвы. Внесением удобрений можно регулировать соотношение поглощенных катионов в почве. Известкование дерново-подзолистых почв и гипсование солонцовых увеличивают содержание кальция в поглощающем комплексе.
Реакция почвы — существенный фактор, влияющий на высшие растения и микроорганизмы. Удобрения часто изменяют реакцию почвенного раствора (например, при известковании или внесении физиологи чески кислых солей).
Реакция почвенного раствора (как и всякого другого раствора определяется концентрацией находящихся в нем ионов водорода (Н+): гидроксила (ОН-). В чистой воде, имеющей нейтральную реакцию, концентрация ионов водорода равна концентрации ионов гидроксила. При электролитической диссоциации воды получается равное количеств ионов Н+ и ОН-. Степень диссоциации воды очень мала. Концентрация ионов водорода в чистой воде равна 1/107 г/л. Соляная и азотная ки< лоты в разведенном растворе диссоциируют полностью, поэтому есл к 1 л воды добавить 1 мэкв НС1, то в растворе будет около 1 мэкв Н+ т. е. 0,001 г= 1/103Н+. Упрощенно концентрацию ионов водорода выр; жают через рН (отрицательный логарифм концентрации ионов водор< да). Так как в нейтральном растворе концентрация ионов водород равна 0,0000001 = 1-10-7, то рН 7.
Реакция почвенных растворов может колебаться в довольно значительных пределах, начиная от рН 3—3,5 (это самая кислая реакция которая характерна для сфагновых торфов и лесных подстилок сфагновых лесов) и кончая рН 10—11 (такая щелочная реакция может бы у солонцов).
Раствор будет щелочным, если концентрация ионов ОН- больше концентрации Н+, чем в чистой нейтральной воде. Следовательно, если рН меньше 7, то это означает кислую реакцию, рН равен 7 — нейтральную, рН больше 7 — щелочною.
Концентрации ионов водорода и гидроксила находятся в такой зависимости: Н+ + ОН- = 10 -14, т. е. чем больше концентрация ионов гидроксила, тем меньше концентрация ионов водорода и наоборот.
В почвенном растворе всегда содержится углекислота, которая образуется в результате биологической деятельности. Она оказывает подкисляющее действие на почвенный раствор:
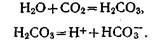
Однако эта кислотность подвергается нейтрализации поглощенными основаниями (кальция и магния) и карбонатами тех же металлов:
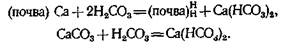
Если в поглощающем комплексе почвы содержится поглощенный натрий, то в растворе возможно образование бикарбоната или карбоната натрия:
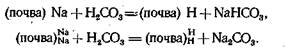
Углекислые соли в растворе подвергаются гидролитической диссоциации:
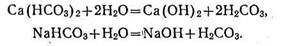
Так как Са(ОН)2 и NaOH — сильные основания, а Н2СОз— очень слабая кислота, то при растворении углекислых солей в воде вследствие преобладания ОН- реакция смещается в щелочную сторону. Особенно резко подщелачивает раствор карбонат натрия, слабее — бикарбонат натрия и еще слабее — бикарбонаты магния и кальция.
Таким образом, реакция почвенного раствора разных почв зависит от состава поглощенных катионов и наличия в почве карбонатов. Если в поглощающем комплексе много натрия (солонцы, солончаки), то реакция почвенного раствора определяется наличием углекислых солей. У этих почв она бывает равной 8—8,5. При преобладании в поглощающем комплексе катионов кальция или присутствии карбонатов кальция и магния (карбонатные почвы, многие черноземы) реакция регулируется главным образом присутствием в почвенном растворе бикарбоната кальция; рН таких почв колеблется в пределах 7—8. Если же в почве кроме кальция и магния присутствуют алюминий и водород (выщелоченные и деградированные черноземы, дерново-подзолистые почвы), реакция почвенного раствора определяется одновременно присутствием свободной углекислоты и бикарбоната кальция (Н2СО3 + Са(НСОз)2, а также растворимых органических кислот и их солей. Чем меньше кальция и больше водорода, тем меньше будет Са(НСОз)2 и больше свободной Н2СОз, рН колеблется от 5 до 7.
Кроме СО2 и органических кислот почвенный раствор могут подкислять и соли алюминия:
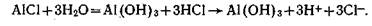
Реакция почвенного раствора сильнокислых почв может опуститься до 3,5—4.
Различают активную кислотность и потенциальную, которая подразделяется на обменную и гидролитическую. Активная кислотность почвенного раствора создается углекислотой (Н2СОз) и частично растворимыми органическими кислотами и гидролитически кислыми солями. Обнаруживается она определением рН почвенного раствора или водной вытяжки из почвы. Обменная кислотность создается наличием ионов водорода и алюминия в обменном состоянии почвы, которые вытесняются при взаимодействии нейтральной соли с почвенным поглощающим комплексом:
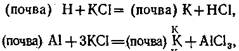
Внесение удобрений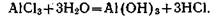 на почвах с обменной кислотностью может вызвать еще большее подкисление, поэтому при применении удобрений с этим нужно считаться.
на почвах с обменной кислотностью может вызвать еще большее подкисление, поэтому при применении удобрений с этим нужно считаться.
Гидролитическая кислотность почвы образуется при действии гидролитически щелочной соли (CH3COONa) на почвенный поглощающий комплекс. Уксуснокислый натрий сообщает раствору щелочную реакцию:
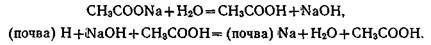
Выщелоченные и оподзоленные черноземы имеют гидролитическую-кислотность. Определение гидролитической кислотности имеет большое практическое значение в связи с применением удобрений (известкованием, применением фосфоритной муки).
Степень насыщенности почв основаниями показывает, какая доля: от общей емкости поглощения приходится на поглощенные основания:
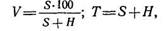
где V — степень насыщенности основаниями (%); 5 — сумма поглощенных оснований (мэкв); Н — гидролитическая кислотность (мэкв); Т — емкость поглощения.
Буферность почвы — это способность почвы противостоять изменению реакции почвенного раствора в кислую или щелочную сторону, например: СН3СООН= СН3СОО-+Н+. Если к такому раствору прибавить щелочь, то равновесие сместится, и часть молекул СНзСООН перейдет в диссоциированное состояние. Поэтому рН раствора изменится мало; раствор будет оказывать буферное действие против подщелачивания. Раствор смеси слабой кислоты и ее соли, например СНзСООН и СНзСОСNа, будет буферным также и по отношению к подкислению. Под влиянием электролитической диссоциации соли подавляется диссоциация и без того слабой кислоты:
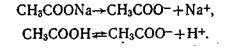
Если к такой смеси прибавить сильную кислоту, то ионы водорода будут соединяться с анионами СН3СОО- и переходить в недиссоциированное состояние, поэтому рН будет изменяться мало — раствор будет буферить против подкисления. Подобного рода буферностью обладает почвенный раствор, так как в нем присутствуют слабые кислоты и их соли (например, углекислота, органические кислоты, фосфаты).
Буферность проявляется в том случае, если в почвенно-поглощающем комплексе присутствуют кальций, магний и другие элементы.
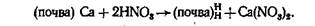
Чем больше емкость поглощения почвы и степень насыщенности почвы основаниями, тем более сильными буферными свойствами она обладает. Буферное действие против смещения реакции в щелочную сторону также связано с поглощающим комплексом, с обменной и гидролитической кислотностью:
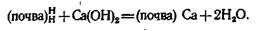
Чем больше гидролитическая кислотность почвы, тем активнее почва будет противодействовать изменению реакции а сторону подщелачивания.
Таким образом, буферное действие почвы в основном определяется степенью насыщенности почвы основаниями и величиной емкости поглощения. Чем больше степень насыщенности почвы основаниями и меньше гидролитическая кислотность, тем устойчивее почва против изменения реакции в кислую сторону. В случае низкой степени насыщенности, наоборот, особенно сильно проявляется сопротивляемость почвы против подщелачивания.
Применение возрастающих количеств агрохимических средств в интенсивном земледелии существенно влияет на плодородие и свойства почвы, что в свою очередь определяет величину урожая сельскохозяйственных культур и качество продукции. Необходимы глубокие знания комплекса факторов и процессов, протекающих в системе «почва — удобрение — растение», важнейшие из которых следующие: 1) изменение свойств и плодородия почвы при систематическом применении удобрений в сочетании с другими приемами агротехники; 2) круговорот и баланс питательных веществ и гумуса в почве и их регулирование; 3) исследование и создание комплекса оптимальных параметров основных показателей плодородия почв.
Скорость и степень разложения органических удобрений зависят также от обогащенности почв микроорганизмами, их состава и биологической активности, а также от условий, определяющих жизнедеятельность микроорганизмов (сложения почвы, ее структуры и аэрации, гидротермического режима и физико-химических свойств, от наличия в ней питательных веществ и т.д.). Интенсивность минерализации органических удобрений в значительной степени определяется их биогенностью.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 443; Нарушение авторских прав?; Мы поможем в написании вашей работы!