
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формы углерода
|
|
|
|
Fe
Si
Химический состав гранулометрических фракций
Распределение химических элементов по отдельным гранулометрическим фракциям сильно различается (табл. 2.).
Таблица 2.
Валовой состав гранулометрических фракций песчаного подзола
на глубине (2-10 см) в % на прокаленную почву
| Размер фракций (мм) | SiO2:Al2O3 | SiO2 | Al2O3 | Fe2O3 | MgO | K2O |
| 1-0,25 | 58,3 | 96,87 | 1,66 | 0,25 | 0,00 | 0,48 |
| 0,25-0,1 | 19,9 | 92,95 | 4,68 | 0,39 | 0,00 | 1,25 |
| 0,1-0,01 | 11,1 | 87,66 | 7,90 | 1,18 | 0,00 | 1,54 |
| 0,01-0,001 | 4,2 | 74,13 | 17,58 | 1,43 | 0,10 | 3,41 |
| < 0,001 | 2,2 | 61,33 | 27,42 | 3,46 | 0,52 | 3,56 |
Наиболее высокое содержание Si отмечается в крупных фракциях, обогащенных кварцем. В более тонких фракциях увеличивается участие полевых шпатов и других первичных минералов. В связи с этим растет содержание алюминия, железа и других элементов.
Различие в валовом химическом составе отдельных горизонтов профиля при однородной почвообразующей породе, используется для суждений о химических преобразованиях породы и дифференциации профиля в процессе почвообразования. Существенные различия в составе горизонтов характерны для почв с элювиально-иллювиально дифференцированным профилем.
Для понимания причин формирования валового химического состава почвы и его изменений по профилю, необходимо учитывать, что содержание отдельных элементов определяется присутствием их в почве в составе разнообразных конкретных минеральных и органических соединений.
Присутствует в породе в виде кварца и в меньшей мере первичных и вторичных силикатов и алюмосиликатов. В ряде случаев может присутствовать аморфный кремнезем (опал, халцедон), генезис которых в почве связан с биогенными или гидрогенными процессами. Валовое содержание колеблется от 40-70% в глинистой почве до 90-98% в песчаных. В ферралитных почвах его содержание может быть много ниже.
Al
Содержание его обусловлено в основном присутствием полевых шпатов и глинистых минералов, а также слюд, эпидотов и других богатых алюминием минералов. Может присутствовать и свободный глинозем в виде бемита, гидраргиллита в аморфной или кристаллической форме. Валовое содержание колеблется от 1-2 до 15-20 %, а в ферраллитных почвах может превысить 40 %.
Присутствует в почвах в составе как первичных, так и вторичных минералов, таких как магнетит, гематит, глауконит, роговая обманка, пироксены, биотит, хлорит, глинистые минералы, минералы группы оксидов железа. Много в почве содержится и аморфных соединений железа. Общее содержание в почве Fe2O3 колеблется в очень широких пределах (в %):
0,5-1,0 в кварцево-песчаных почвах
3-5 в почвах на лессах
8-10 в почвах на элювии плотных ферромагнезиальных пород
20-50 в ферраллитных почвах и латеритах тропиков
В почве также наблюдаются часто железистые прослои – ортзанды, образующиеся на капиллярной кайме или на контакте между слоями различного гранулометрического состава.
Согласно С.В. Зонну соединения железа в почве представлены следующими формами:
1. Силикатное железо, входящее в состав кристаллической решетки силикатов
2. Несиликатное (свободное): окристаллизованное (оксиды, гилрооксиды); аморфные соединения (гидрооксиды железа, гумусово-железистые комплексы); подвижные (обменные и водорастворимые).
Са
В бескарбонатных суглинистых почвах составляет 1-3 %. Определяется присутствием глинистых минералов тонкодисперсных фракций, а также гумусом и органическими остатками в связи с чем наблюдается тенденция к биогенному обогащению кальцием верхней органо-аккумулятивной части профиля. В ряде случаев содержание Са повышается в связи с присутствием в крупных фракциях обломков карбонатных пород и первичных кальцийсодержащих минералов (кальцита, гипса, основных плагиоклазов).
В почвах сухостепной и аридной зон повышенное валовое содержание кальция может быть определено образованием и накоплением вторичного кальцита или гипса в процессе почвообразования. Много Са может накопиться в почве гидрогенным путем.
Мg
Валовое содержание обычно близко содержанию Са и обусловлено присутствием глинистых минералов, особенно монтмориллонита, вермикулита, хлорита.
В крупных фракциях магний содержится в обломках доломитов, оливине, роговых обманках, пироксенах. В почвах аридной зоны много магния аккумулируется при засолении почвы в виде хлоридов и сульфатов.
К
Содержание К2О составляет в почвах 2-3 %. Присутствует К чаще в глинистых минералах тонкодисперсных фракций, особенно в гидрослюдах, а также в слюдах, калиевых полевых шпатах.
Na
Валовое содержание обычно 1-3 %. Присутствует в составе первичных минералов – натрийсодержащих полевых шпатах. В илистой фракции его содержание не превышает 0,5-1 %. В засоленных почвах сухостепных и аридных зон в значительных количествах может присутствовать в виде хлоридов или входит в почвенно-поглощающий комплекс. Дефицита натрия в почве на наблюдается. Присутствие натрия в повышенных количествах в составе подвижных соединений обуславливает наличие у почв неблагоприятных физических и химических свойств. Почвы теряют структуру, становятся водонепроницаемыми.
С, N, Р принадлежат к числу важнейших органогенов. Присутствие их в почве обязано воздействию живого вещества и процессам почвообразования.
С
В почве содержится главным образом в составе гумуса и органических остатков. Много С может находиться в составе карбонатов. Содержание С в почве колеблется от долей % до 3-5 и 10%.
N
Целиком связан в почве с гумусом, составляет 1/10-1/20 часть от содержания С. Содержание его в почве 0,3-0,4, часто 0,1 и меньше. Азот играет чрезвычайно важную роль в плодородии почвы, т.к. жизненно необходим растениям. Для растений он доступен только в форме нитратного и аммонийного ионов. Большинство культурных почв нуждается в систематическом внесении азота.
Р
Присутствует в почвах в очень незначительных количествах. Валовое содержание составляет 0,1-0,2 %. Р жизненно важен для растений. Но в большинстве почвах, особенно песчаных, находится в резком дефиците. В связи с этим необходимо внесение Р в почву. В почве Р присутствует в составе гумуса, органических остатков, в минералах в составе апатита, вивианита.
Биогеохимический цикл кислорода
Он определяет окислительно-восстановительные и щелочно-кислотные условия растворов. Для него характерна как ионная, так и неионная форма миграции в растворах.
Эволюция геохимических процессов на Земле сопровождается неуклонным увеличением содержания кислорода. В настоящее время количество кислорода в атмосфере составляет 1,2х1015 тонн. Масштабы продуцирования кислорода зелеными растениями таковы, что это количество могло быть удвоено за 4000 лет. Но этого не происходит, так как в течение года разлагается примерно такое же количество органического вещества, которое образуется в результате фотосинтеза. При этом поглощается почти весь выделившийся кислород. Но благодаря незамкнутости биогеохимического круговорота в связи с тем, что часть органического вещества сохраняется и свободный кислород постепенно накапливается в атмосфере.
Еще один миграционный цикл свободного кислорода связан с массобменом в системе природные воды – тропосфера. В воде океана находится от 3х109 до 10х109 м3 растворенного кислорода. Холодная вода высоких широт поглощает кислород, а, поступая с океаническими течениями в тропики – выделяет его в атмосферу. Поглощение и выделение кислорода происходит и при смене сезонов года, сопровождающихся изменением температуры воды.
Кислород расходуется в громадном количестве окислительных реакций, большинство из которых имеет биохимическую природу. В этих реакциях высвобождается энергия, поглощенная в ходе фотосинтеза. В почвах, илах, водоносных горизонтах развиваются микроорганизмы, использующие кислород для окисления органических соединений. Запасы кислорода на нашей планете огромны. Он входит в состав кристаллических решеток минералов и высвобождается из них живым веществом.
Таким образом, общая схема круговорота кислорода в биосфере складывается из двух ветвей:
· образование свободного кислорода при фотосинтезе;
· поглощение кислорода в окислительных реакциях
Согласно расчетам Дж. Уолкера (1980) выделение кислорода растительностью мировой суши составляет 150х1015 тонн в год; выделение фотосинтезирующими организмами океана – 120х1015 тонн в год; поглощение в процессах аэробного дыхания – 210х1015 тонн в год; биологическая нитрификация и другие процессы разложения органического вещества – 70х1015 тонн в год.
В биогеохимическом круговороте можно выделить потоки кислорода между отдельными компонентами биосферы (рис. 2).
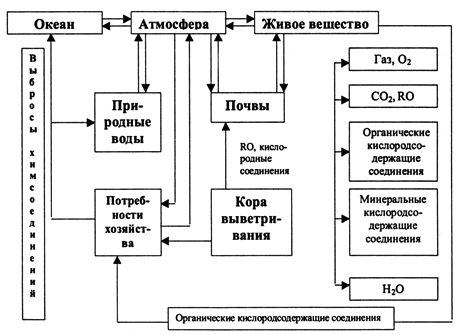
Рис. 2. Схема биогеохимического цикла кислорода
В современных условиях установившиеся в биосфере потоки кислорода нарушаются техногенными миграциями. Многие химические соединения, сбрасываемые промышленными предприятиями в природные воды, связывают растворенный в воде кислород. В атмосферу выбрасывается все большее количество углекислого газа и различных аэрозолей. Загрязнение почв и, особенно, вырубка лесов, а также опустынивание земель на огромных территориях уменьшают производство кислорода растениями суши. Огромное количество атмосферного кислорода расходуется при сжигании топлива. В некоторых промышленно развитых странах кислорода сжигают больше, чем образуется его за счет фотосинтеза.
Биогеохимический цикл водорода
Содержание водорода в земной коре, в отличие от кислорода сравнительно невелико. Большая часть атомов водорода здесь входит в состав воды, нефти, горючих газов, некоторых минералов. Геохимия водорода тесно связана с историей воды и живого вещества. Кларк водорода гидросферы – 2,72, а живого вещества – 10,5.
В земной коре свободный водород неустойчив. Он быстро соединяется с кислородом, образуя воду, а также участвует в других реакциях. Способен улетучиваться в космос (диссипировать). Значительное количество водорода поступает на поверхность Земли при вулканических извержениях.
Организмы закрепляют водород в биосфере планеты, связывая его не только в органическом веществе, но и участвуя в фиксации водорода минеральным веществом почвы. Это становится возможным в результате диссоциации кислотных продуктов метаболизма с высвобождением иона Н+. Последний, как правило, образует с молекулой воды посредством водородной связи ион гидроксония (Н3О+). При поглощении иона гидроксония некоторыми силикатами происходит их трансформация в глинистые минералы. Из циклических процессов на поверхности Земли, в которых участвует водород, один из наиболее мощных – круговорот воды: ежегодно через атмосферу проходит более 520 тысяч кубометров влаги. Для создания фитомассы Мировой суши, существовавшей до вмешательства человека, по данным В.В. Добровольского (1998) было расщеплено примерно 1,8х1012 тонн воды и, соответственно, связано 0,3х1012 тонн водорода.
В процессе круговорота воды в биосфере происходит разделение изотопов водорода и кислорода. Пары воды при испарении обогащаются легкими изотопами, поэтому атмосферные осадки, поверхностные и грунтовые воды также обогащены легкими изотопами по сравнению с океаническими водами, имеющими устойчивый изотопный состав.
Биогеохимический цикл азота
Азот и его соединения играют в жизни биосферы такую же важную и незаменимую роль, как и углерод. Биофильность азота сравнима с биофильностью углерода. Индекс биогенного обогащения почв по отношению к земной коре, а растений по отношению к почвам составляет для азота 1000 и 10000 соответственно (Ковда, 1985).
Основным резервуаром азота в биосфере также является воздушная оболочка. Около 80% всех запасов азота сосредоточено в атмосфере планеты, что связано с направлением биогеохимических потоков соединений азота, образующихся при денитрификации. Основной формой, в которой содержится азот в атмосфере, является молекулярная – N2. В качестве несущественной примеси в атмосфере содержатся различные оксидные соединения азота NOx, а также аммиак NH3. Последний в условиях земной атмосферы наиболее неустойчив и легко окисляется. В то же время, величина окислительно-восстановительного потенциала в атмосфере недостаточна и для устойчивого существования оксидных форм азота, потому его свободная молекулярная форма и является основной.
Первичный азот в атмосфере, вероятно, появился в результате процессов дегазации верхней мантии и из вулканических выделений. Фотохимические реакции в высоких слоях атмосферы приводят к образованию соединений азота и заметному поступлению их на сушу и в океан с атмосферными осадками (3-8 кг/га аммонийного азота в год и 1,5-6 кг/га нитратного). Этот азот также включается в общий биогеохимический поток растворенных соединений, мигрирующих с водными массами, участвует в почвообразовательных процессах и в формировании биомассы растений.
В отличие от углерода, атмосферный азот не может напрямую использоваться высшими растениями. Поэтому ключевую роль в биологическом круговороте азота играют организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие способностью путём прямой фиксации непосредственно извлекать азот из атмосферы и, в конечном счёте, связывать его в почве.
В результате деятельности организмов – фиксаторов азота он связывается в почвах в нитритной форме (соединения на основе NH3).
Нитритные соединения азота способны мигрировать в водных растворах. При этом они окисляются и преобразуются в нитратные – соли азотной кислоты HNO3. В этой форме азотные соединения способны эффективно усваиваться высшими растениями и использоваться для синтеза белковых молекул на основе пептидных связей C-N. Далее, по трофическим цепям, азот попадает в организмы животных. В окружающую среду (в водные растворы и в почву) он возвращается в процессах выделительной деятельности животных или разложения органического вещества.
Возврат свободного азота в атмосферу, как и его извлечение, осуществляется в результате микробиологических процессов. Это звено круговорота функционирует благодаря деятельности почвенных бактерий-денитрификаторов, вновь переводящих азот в молекулярную форму.
В литосфере, в составе осадочных отложений, связывается весьма небольшая часть азота по причине, очень хорошей растворимости. Выпадение некоторой доли азота из биологического круговорота также компенсируется вулканическими процессами. Благодаря вулканической деятельности в атмосферу поступают различные газообразные соединения азота, который в условиях географической оболочки Земли неизбежно переходит в свободную молекулярную форму.
Таким образом, основными специфическими чертами круговорота азота в биосфере можно считать следующие:
· преимущественную концентрацию в атмосфере, играющей исключительную роль резервуара, из которой живые организмы черпают запасы необходимого им азота;
· ведущую роль в круговороте азота почв и, в особенности, почвенных микроорганизмов, деятельность которых обеспечивает переход азота в биосфере из одних форм в другие (рис. 3).

Рис.3. Схема биогеохимического цикла азота
Поэтому огромное количество азота в связанном виде содержит биосфера: в органическом веществе почвенного покрова (1,5х1011 т), в биомассе растений (1,1х109 т), в биомассе животных (6,1х107 т). В больших количествах азот содержится и в некоторых биогенных ископаемых (селитры).
Поступление за счет азотных удобрений составляет 30% от общих поступлений азота на сушу и в океан. Особенно велики потери нитратных форм азота, так как он не сорбируется почвой, легко вымывается природными водами, восстанавливается в газообразные формы и до 20-40% его теряется для питания растений. Существенным нарушением цикла азота является и все возрастающее количество отходов животноводства, промышленных отходов и стоков больших городов, поступление в атмосферу аммония и оксидов азота при сжигании топлива.
Геохимический цикл углерода — это комплекс процессов, в ходе которых происходит перенос углерода между различными геохимическими резервуарами. Важнейшую роль в круговороте углерода играли и играют живые организмы. В различных формах углерод присутствует во всех оболочках Земли.
Геохимический цикл углерода имеет несколько особенностей:
- Разные процессы контролировали углеродный цикл на разных промежутках времени.
- Резкие, катастрофические изменения цикла углерода играли ключевую роль в эволюции углеродного цикла в истории Земли.
- Геохимический цикл углерода всегда происходит через атмосферу и гидросферу.
Геохимическая запись углеродного цикла изучена наиболее полно в отношении четвертичного периода, самый недавний и кратчайший геологический период, так как, с одной стороны, история углеродного цикла в нём наиболее полно зафиксирована ледниками Арктики и Антарктики, с другой стороны, в это время происходили значительные изменения углеродного цикла, и они неразрывно связаны с климатическими изменениями.
Углерод присутствует в природе в нескольких основных формах:
- восстановленная форма в виде метана и других углеводородов содержится в мантии, коре, атмо- и гидросфере
- в нейтральном состоянии в виде графита, алмаза и карбида в коре и мантии
- в окисленной форме в виде углекислого газа, карбонатов и примеси в силикатах в мантии, коре и атмо- и гидросфере
- в виде сложных биоорганических соединений углерод сосредоточен в биосфере, почве, и океане.
Перенос углерода между различными геохимическими резервуарами осуществляется через атмосферу и мировой океан. При этом углерод в атмосфере находится в виде углекислого газа и метана.
|
|
|
|
|
Дата добавления: 2014-01-04; Просмотров: 634; Нарушение авторских прав?; Мы поможем в написании вашей работы!