
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова атома карбону
|
|
|
|
ВСТУП
ОСНОВИ БУДОВИ ТА РЕАКЦІЙНОЇ ЗДАТНОСТІ ОРГАНІЧНИХ СПОЛУК
Атоми в молекулах певним чином сполучаються між собою і утримуються разом внаслідок електростатичної взаємодії електронів та ядер атомів (ядерно-електронна взаємодія). Таке об’єднання двох атомів називається локалізованим хімічним зв’язком, в якому електрони розподілені між двома ядрами і природа якого залежить, головним чином, від природи атомів (учасників зв’язку), що його утворили.
Хімічний зв'язок це сукупність сил, що діють між двома або групою атомів і обумовлюють утворення стійкої системи (молекули, складного іона, радикала, тощо).
Взагалі, хімічний зв’язок – це сила, яка утримує атоми в молекулах.
В органічній хімії всі хімічні зв’язки поділяються на три типи: іонні, ковалентні та водневі.
На початковій стадії розвитку електронної теорії В.Коссель і Г.Льюїс (1916 р.) розробили октетну теорію хімічних зв’язків на таких засадах:
а) найбільш стабільними є сполуки, в атомах яких зовнішня електронна оболонка заповнена як в інертних газах (для елементів першого періоду – 2 електрони, для елементів другого періоду – 8 електронів);
б) зв’язки утворюються внаслідок прагнення атомів мати стабільну конфігурацію зовнішніх електронних оболонок.
Типи хімічних зв’язків та їх основні характеристики
 |
Іонний зв’язок -утворюється за рахунок електростатичного притягання різнойменно заряджених йонів, виникають внаслідок переносу електронів від менш електронегативного атома до більш електронегативного.
х – електрон М-оболонки,
· - електрон L-оболонки.
Перерозподіл зовнішніх електронів атомів до октетного або дублетного стану, тобто до стабільної конфігурації інертних газів, є необхідною умовою для утворення іонного зв’язку.
Ковалентний зв’язок утворюєтьсявнаслідок узагальнення пари зовнішніх валентних електронів двох атомів (комбінаційний механізм).
В залежності від електронегативності атомів, які утворюють ковалентний зв’язок, розрізняють два різновиди ковалентних зв’язків – неполярний, який утворюють атоми з однаковою електронегативністю (наприклад, Н-Н) та поляр-ний, який утворюють атоми з різною електронегативністю (наприклад, H-F). Утворення ковалентних зв’язків цих різновидів можливо уявити як результат узагальнення неспарених валентних електронів з протилежними спінами двома атомами, що утворюють ковалентний зв’язок:
 |
Інший механізм утворення ковалентного зв’язку – донорно-акцепторний (координаційний) зв’язок - має місце у випадку, коли один атом надає пару неподілених електронів (донор), а інший, якому до заповнення зовнішньої оболонки не вистачає двох електронів і має вільну орбіталь (акцептор), їх приймає:

донор акцептор іон аммонію
 |
донор акцептор іон диметилоксонію
Різновидом донорно-акцепторної взаємодії є семіполярний зв’язок, при утворені якого атом-донор набуває позитивного заряду, а атом–акцептор – негативного:
 |
донор акцептор N-оксид триметиламіну
Характеристики ковалентного зв’язку.
1. Довжина зв’язку (l) - це відстань між ядрами атомів, які його утворюють; вимірюється в нм. Довжина більшості зв’язків в органічних сполуках знаходиться в межах 0,108 нм (С-Н) – 0,221 нм (C-J). Довжина окремого зв’язку не є константою і залежить від його хімічного оточення (наприклад, довжина зв’язку С-J в СН3СН2J становить 0,221 нм, а в HC º CJ - 0,200 нм).
Загальні зауваження: а) кратні зв’язки завжди коротші, ніж одинарні; б)прямої залежності між довжиною зв’язку та його реакційною здатністю немає, але для однотипних зв’язків існує пропорційність – чим коротший зв’язок, тим менша його реакційна здатність.
2. Валентний кут. Змінюється в інтервалі 90-180° (наприклад, валентний кут в H-S-H становить 92°,а в HCºCH -180°). При відхиленні валентного кута в силу тих чи інших обставин від свого нормального значення зростає реакційна здатність відповідних зв’язків.
3. Полярність зв’язку визначається ступенем зміщення спільної електронної пари до більш електронегативного атому. Кількістно характеризується дипольним моментом (m = ld) і вимірюється в Дебаях (D). Збільшення полярності зв’язку за інших однакових умов приводить до зростання його реакційної здібності:
С-С m =0, Е=346 кДж/моль (пасивний зв’язок),
С-О m =1,47, Е=339 кДж/моль (активний зв’язок).
4. Поляризовність зв’язку визначається здатністю до поляризації, тобто здатністю зміщувати електрони під дією зовнішніх чинників (реагентів, розчинників, каталізаторів і т.д.).Вимірюється рефракцією зв’язку (RD) в см3. Реакційна здатність зв’язку прямо пропорційна його поляризовності:
С-С RD 1,40 см3 (пасивний зв’язок),
С=С RD 4,17 см3 (активний зв’язок).
5. Енергія зв’язку - це енергія, яка необхідна для його розриву. Енергія зв’язку в органічних сполуках коливається в межах 210 (C-J) - 820 (CºC) кДж/моль. Енергія зв’язку обернено пропорційна його реакційній здатності:
EF-F 159,6 кДж/моль (активний зв’язок),
EН-Н 438,6 кДж/моль (пасивний зв’язок).
Енергія зв’язку залежить від його хімічного оточення. Так, енергія зв’язку О-О в НО-ОН становить 209,3 кДж/моль, а в С6Н5COO-OOСС6Н5 -125,6 кДж/моль.
Атоми елементів складаються з позитивно зарядженого ядра та електронної оболонки, заповненої електронами. Електрон має двоїсту природу. Це негативно заряджена частинка, яка має хвильові властивості. Делокалізація електрона у полі атомного ядра описується за допомогою хвильової функції електрона y, що входить до складу хвильового рівняння Шредінгера, яке являє собою математичну модель електрона:
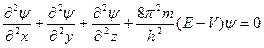 ,
,
де m- маса електрона, h – стала Планка,
Е – повна енергія електрона, V – потенційна енергія електрона.
Фізичний зміст y: Квадрат хвильової функції ½ y2 ½ описує вірогідність (dP) знаходження електрона в елементарному об’ємі dV, який оточує точку з координатами x, y, z: dP=y2(x,y,z)dV. Якщо об’єм вибрати таким чином, що вірогідність знаходження в ньому електрона становить 95%, то роз'вязуючи рівняння Шредінгера, ми знайдемо зображення поверхні, яка відокремлює деякий об’єм V з 95% вірогідністю знаходження електрона в ньому. Цей об’єм має назву атомної орбіталі (АО). Атомні орбіталі бувають s, p, d і т.д. типів (Рис.1). При цьому радіуси s- і p- АО одного і того ж рівня відносяться як 1:  .
.

Рис.1 Основні типи атомних орбіталей
Атомна орбіталь характеризується енергією (залежить від головного квантового числа n), формою орбіталі (залежить від орбітального квантового числа l), радіусом орбіталі, наявністю вузлової площини (площини, в якій вірогідність знаходження електрона дорівнює нулю, а хвильова функція y змінює свій знак на протилежний) та знаком хвильової функції.
Електрони заповнюють атомні орбіталі відповідно правилам:
Принцип В.Паулі:
1. Дану орбіталь можуть займати лише 2 електрони при умові, що вони мають протилежні (антипаралельні) спіни. Ці електрони називаються спареними. Електрони ж з однаковими спінами відштовхуються і намагаються розійтися на максимально можливу відстань.
2. Кожна нова орбіталь заповнюється лише після того, як будуть заповнені всі попередні, більш стабільні орбіталі з нижчою енергією, які знаходяться ближче до ядра.
Правило Ф.Гунда:
При заповненні орбіталей з однаковою енергією (вироджених орбіталей) спочатку на кожній з них розміщується по одному електрону з паралельними спінами, потім орбіталі починають заповнюватись другими електронами з антипаралельними спінами.
Метод валентних зв’язків
Для опису хімічних зв’язків в органічних сполуках використовують два методи - метод валентних зв’язків (ВЗ) та метод молекулярних орбіталей (МО).
Основні положення методу ВЗ:
1.Хімічний зв’язок між атомами утворюється при перекриванні атомних орбіталей двох електронів.
2. Пара електронів, яка утворює зв’язок, зосереджена (локалізована) між двома атомами – учасниками зв’язку.
3. Кожний зв’язок утворюється парою електронів з антипаралельними спінами.
Таким чином, в основі методу ВЗ знаходиться хімічний зв’язок як результат узагальнення двома атомами пари електронів, яка знаходиться на електроній орбіталі, утвореній в результаті перекривання двох атомних орбіталей. При цьому більша частина енергії зв’язку між двома атомами, які знаходяться на рівноважній міжядерній відстані, реалізується внаслідок швидкого обміну (резонансу) електронів між двома ядрами. Крива потенційної енергії, в залежності від міжядерної відстані, має глибокий мінімум на міжядерній відстані, яка відповідає довжині зв’язку. В цьому випадку врівноважуються сили електронно-ядерного притягнення та ядерно-ядерного відштовхування.

Рис.2 Залежність потенційної енергії двохатомної молекули від між’ядерної відстані
Будь-який зв’язок утворюється в області максимального перекривання атомних орбіталей; із збільшенням ступеню перекривання (інтегралу перекривання) міцність зв’язку зростає. Утворення зв’язку за рахунок напрямлених орбіталей завжди приводить до більш міцного зв’язку, ніж при перекриванні сферичних s-орбіталей.
У методі ВЗ, для пояснення електронної будови молекули застосовують ізольовані АО, власну взаємодію яких між собою не враховують. Метод ВЗ дозволяє пояснити насиченість хімічного зв’язку, його напрямленість у просторі та енергію активації.
В рамках методу ВЗ виникла необхідність розглянути природу орбіталей атома карбону, завдяки яким утворюються зв’язки в органічних сполуках. Відомо, що атом карбону в метані СН4 утворює чотири рівноцінних зв’язки
С-Н, хоча електронна будова атома С - 1s22s22p2 - вказує на його теоретичну двовалентність. Ця суперечність була усунена за допомогою концепції гібридизації АО (Л.Полінг та Д.Слейтер, 1927-1934 рр.).
Існування чотирьох еквівалентних зв’язків С-Н в метані можна пояснити, застосовуючи таке припущення. При нагріванні або опромінюванні основного стану атома С відбувається перехід одного електрона з 2s -підрівня на 2р -підрівень з утворенням збудженого стану С* з електронною конфігурацією 1s22s12p3 . В подальшому залишкова 2s -орбіталь змішується (гібридизується) з трьома іншими 2р -орбіталями з утворенням чотирьох однакових гібридних орбіталей. Тобто 4 АО атома С (2s, 2px, 2py, 2pz) замінюються набором 4 еквівалентних гібридних АО, названих sp3 -гібридними АО.
 |
Будова атома С в основному, збудженому та sp3 -гібридному станах:
Рис.3 Різні стани атома карбону
Це припущення має два важливі наслідки:
1. Атом С має можливість утворювати не два, а чотири ковалентні зв’язки;
2. Гібридні АО, які утворюються, мають осьову симетрію і напрямленність в просторі, що забезпечує більш ефективне перекривання з іншими АО при утворенні хімічних зв’язків. При цьому енергія, необхідна для переходу атома С з основного стану (електронна конфігурація 1s22s22p2) в збуджений (електронна конфігурація 1s22s2p3) з послідуючою гібридизацією (електронна конфігурація 1s22(sp3)4) з лихвою компенсується утворенням чотирьох більш міцних ковалентних зв’язків.
Утворення хімічних зв’язків в ненасичених органічних сполуках – похідних етилену та ацетилену – пояснюється припущенням, що атом С може існувати також в sp2 - та sp -гібридних станах, відповідно.
Для пояснення можливості утворення гібридних орбіталей в методі ВЗ розглянемо принципову схему утворення sp- гібридних орбіталей, як найбільш доступну для розуміння.
Змішування s -орбіталі з px -орбіталлю одного і того ж атома карбону фактично є наслідком комбінації хвильових функцій електронів, які займають ці орбіталі. При цьому, якщо знак хвильових функцій електронів (орбіталей) збігається, результуюча хвильова функція підсилюється, якщо ж знак хвильових функцій протилежний – результуюча хвильова функція послаблюється. Лінійна комбінація s - і рх -орбіталей є наслідком алгебраїчної суми (попарного додавання та віднімання) їх хвильових функцій.
Відповідно, sp -гібридизацію атома С можна записати таким чином:
(s + px) + py + pz → 2sp + py + pz

Рис.4 Схема sp -гібридизації атома карбону
Висновок: sp -гібридні орбіталі розташовані одна до одної під кутом 180°,
sp -гібридний стан атома С є лінійним (дигональним), оскільки вихідні s- та px- орбіталі розташовані на одній прямій; молекули, до складу яких входять лише sp-гібридні атоми С, мають лінійну будову (наприклад, ацетилен). Лінійний стан sp -гібридного атома С можна також розглядати як результат електростатичного відштовхування двох заповнених електронами АО.
Утворення sp2- гібридних орбіталей відбувається аналогічно попередньому випадку за рахунок змішування s -орбіталі з px - та py -орбіталями одного і того ж атома карбону.
sp2 -Гібридизацію атома С можна записати так:
(s + px + px) + pz → 3sp2 + pz

Рис.5 Схема sp2 -гібридизації атома карбону
Висновок: sp2 -гібридні орбіталі, розташовані одна до одної під кутом 120°, sp2 -гібридний стан атома С є плоским (тригональним), оскільки вихідні s-, px- та py- орбіталі знаходяться в одній площині; молекули, до складу яких входять лише sp2 -гібридні атоми С, мають плоску будову (наприклад, етилен). Плоский стан sp2 -гібридизованого атома С можна також розглядати як результат електростатичного відштовхування трьох заповнених електронами АО.
Утворення sp3- гібридних орбіталей відбувається аналогічно за рахунок змішування s -орбіталі з px -, py - та pz -орбіталями одного і того ж атома карбону.
sp3 -Гібридизацію атома С можна записати таким чином:
(s + px + px + pz) → 4sp3

Рис.6 Схема sp3 -гібридизації атома карбону
Висновок: sp3 -гібридні орбіталі, розташовані одна до одної під кутом 109°28¢, sp3 -гібридний стан атома С є об’ємним (тетрагональним, тетраедричним), оскільки вихідні орбіталі мають об’ємне розташування; молекули, до складу яких входять sp3 -гібридні атоми С, мають об’ємну будову (наприклад, етан). Об’ємний стан sp3 -гібридного атома С можна розглядати як результат електростатичного відштовхування чотирьох заповнених електронами АО, які не знаходяться в одній площині.
При порівнянні sp -, sp2 - та sp3 -гібридних станів атома С можна дійти до загальних висновків:
1. Радіус гібридних орбіталей зростає в ряду sp < sp2 < sp3, тобто із зменшенням частки s -орбіталі, яка має менший власний радіус та збільшенням частки p -орбіталей, які мають більший власний радіус. В sp -гібридному стані частка s -орбіталі складає 50%, в sp2 -33,3%, в sp3- 25%. При цьому радіус p -орбіталі менший від радіуса sp -гібридної орбіталі.
2. Електронегативність атома С залежить від його гібридного стану і зменшується в ряду sp (3,2) > sp2 (2,75) > sp3 (2,5), тобто із зменшенням частки s- орбіталі в відповідному гібридному стані.
В органічній хімії за способом перекривання АО розглядають два типи ковалентних зв’язків - s - і p -зв’язки.
s- Зв’язки утворюються при осьовому перекриванні атомних орбіталей. В цьому випадку максимальне перекривання відбувається вздовж осі, яка з’єднує два ядра. s -Зв’язки мають циліндричну симетрію, тобто мають вісь обертання безмежного порядку. Прикладами таких зв’язків можуть бути зв’язки H-H та С-Н:

Рис.8 Утворення s -зв’язків в методі ВЗ
p -Зв’язки найчастіше утворюються при боковому (латеральному) перекриванні негібридизованих р -орбіталей:
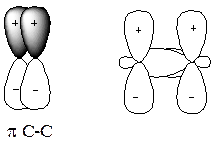
Рис.9 Утворення p -зв’язків в методі ВЗ
Оскільки інтеграл перекривання між р -орбіталями значно менший інтеграла перекривання при утворенні s -зв’язків (див.рис.9), p -зв’язки значно слабші порівняно з s -зв’язками.
Довжини зв’язків та їх енергії залежать від стану гібридизації атома С, вірніше, від власних радіусів орбіталей, які утворюють ці зв’язки: чим менший власний радіус орбіталей, тим меншою є довжина зв’язку і тим більшою є енергія зв’язку.
Зміна довжин зв’язків та їх енергій в залежності від гібридизації атома С:
| Тип зв’язку | l, нм | Е, кДж/моль | Тип зв’язку | l, нм | Е, кДж/моль |
| Csp3-Csp3 | 0,154 | 350 (s) | Csp3-H | 0,120 | 413,7 |
| Csp2-Csp2 | 0,135 | 607,1 (s+p) | Csp2-H | 0,108 | 435,5 |
| Csp-Csp | 0,120 | 822,7 (s+2p) | Csp-H | 0,106 | 469,5 |
Значна зміна довжини зв’язків С-С в порівнянні із зв’язками С-Н при зміні гібридизації атома С обумовлена тим, що:
1. в утворенні зв’язку С-С беруть участь два атоми С, гібридизація яких змінюється. Відповідно, вдвічі більше змінюються відстань між ядрами атомів С;
2. наявність p -зв’язків додатково зближує атоми С.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 9514; Нарушение авторских прав?; Мы поможем в написании вашей работы!