
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Потенциометрическое титрование
|
|
|
|
Потенциометрия — один из самых простых электрохимических методов. В аналитическом контроле нефтехимических производств он используется прежде всего для измерений рН, а также для установления ион- ного состава продуктов.
Электрохимические методы
Светофильтры
Для того чтобы из всей видимой области спектра выделить лучи определенных длин волн при фотоколориметрических определениях на пути световых потоков перед поглощающими растворами помещают избирательные поглотители света, называемые светофильтрами. Светофильтры пропускают лучи лишь в определенном интервале длин волн с полушириной пропускания λ1/2max – λ`1/2max и практически полностью поглощают лучи других длин волн. Наиболее эффективные стеклянные узкополосные светофильтры характеризуются размытостью максимума пропускания 20-30 нм. Светофильтры для фотометрирования выбирают так, чтобы максимум светопоглощения раствора соответствовал максимуму пропускания (минимуму поглощения) светофильтра.
На практике оптимальный светофильтр подбирают экспериментально: светофильтр, при котором абсолютное значение или разность оптических плотностей ΔА двух стандартных растворов с концентрациями С1 и С2 получается максимальной, является наиболее подходящим для фотометрирования данного окрашенного раствора.
Электрохимические методы анализа основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Аналитический сигнал – электрический параметр (потенциал, сила тока, электропроводность), который зависит от концентрации определяемого вещества.
Различают прямые и косвенные электрохимические методы. В прямых методах используют зависимость аналитического сигнала от концентрации определяемого компонента; в косвенных методах – электрический параметр измеряют для нахождения точки эквивалентности при титровании.
Классификация электрохимических методов анализа по измеряемому параметру
| Метод | Измеряемый параметр | Условия измерения |
| Потенциометрия | Потенциал, Е, В | I=0 |
| Кондуктометрия | Удельная электропр-сть, χ, См/см | I=1000 Гц |
| Электрогравиметрия | Масса, м,г | i const или Е const |
| Кулонометрия | Количество электричества, Q, Кл | |
| Вольтамперометрия | Сила тока i, мкА | I=F (Е налож) |
Потенциометрия основана на определении зависимости между равновесным электродным потенциалом (Е) и термодинамической активностью (а) или концентрацией (с) компонентов реакции.
Математическое выражение зависимости описывается уравнением Нернста

где Е0 - стандартный потенциал редокс-системы, равный Еравн , когда активности (а) всех участвующих в ЭХ реакции компонентов равны единице.
R- газовая постоянная, равна 8,3144 Дж/град-моль;
Т-абсолютная температура по Кельвину, К;
А – постоянная Фарадея, А = 96500 Кл/моль;
n – число электронов, участвующих в электродной реакции.
аок, авос – активности окислительной и восстановительной форм редокс системы.
На практике используют концентрации (с), а не активности (а).
а=γ·с,
γ – где коэффициент активности – мера электростатического взаимодействия в системе, безразмерная величина;
с- молярная концентрация.
Подставляя Т=298,15 и числовые значения констант в уравнение получаем
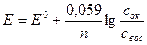
Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и стандартный электрод или электрод сравнения, относительно которого измеряется потенциал индикаторного.
Применяют несколько видов индикаторных и стандартных электродов.
Электроды первого рода
Обратимы относительно ионов металла, из которого состоит электрод. При опускании такого электрода в раствор, содержащий катионы металла образуется электродная пара Мn+ / M, потенциал которой определяется по уравнению Нернста (Обратимость означает, что направление электродной реакции можно изменить, поменяв полярность электрода). Например, медный электрод, опущенный в раствор соли меди Cu2+ составляет электродную пару Cu2+/Cu, потенциал которой зависит от концентрации Cu2+.
Электроды второго рода
Чувствительны к анионам и представляют собой металл М, покрытый слоем нерастворимой его соли МА с анионом А¯, к которому чувствителен электрод. При контакте такого электрода с раствором, содержащим указанный анион А¯, возникает потенциал Е, величина которого зависит от произведения растворимости соли ПРМА и концентрации аниона [А¯] в растворе:


Электродами второго рода являются хлорсеребряный и каломельный, которые в практике используются в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода..
Хлорсеребряный электрод состоит из стеклянной трубки, в которой находится серебряная проволока, покрытая слоем AgCl и опущенная в раствор KCl. Контакт электрода с раствором осуществляется через мостик из асбестовой нити, смоченной раствором КСl, с потенциометром – через серебряную проволоку. Потенциал хлорсеребряного электрода зависит от концентрации КCl в растворе. В 1 М растворе КCl Е=0,220 В, в насыщенном растворе КCl Е=0,199 В по отношению к нормальному водородному электроду.
Каломельный электрод представляет собой стеклянный сосуд, на дно которого налита ртуть, поверх ртути находится паста из каломели Hg2Cl2 и налит раствор KCl. В ртуть опущена платиновая проволока для контакта с прибором, раствор КСl сообщается с анализируемым раствором с помощью электролитического мостика – трубки, заполненным раствором КСl с помощью агар-агара. Потенциал каломельного электрода Е в 1 М растворе KCl равен 0,281 В, в насыщенном - Е=0,244 В.
Инертные электроды
- пластина или проволока, изготовленная из трудноокисляемых металлов – платины,золота, палладия. Применяются для измерения Е в растворах, содержащих окислительно-восстановительную пару (например Fe3+ / Fe2+; Ce4+ / Ce3+; MnO4¯, H+ /Mn2+, H2O и др). Потенциал такого электрода, не принимающего непосредственного участия в электрохимической реакции, определяется соотношением концентраций окисленной и восстановленной форм по уравнению Нернста.
Мембранные электроды - различного типа имеют мембрану, на которой возникает мембранный потенциал Е. Величина Е зависит от разности концентраций одного и того же иона по разные стороны мембраны. Простейшим и наиболее употребительным мембранным электродом является стеклянный электрод. Стеклянный электрод состоит из хлорсеребряного электрода, помещенного в стеклянную трубку с шариком из специального стекла и залитого 0,1 М раствором НСl. Толщина стенок шарика 0,006 – 0,1 мм. Ионы щелочных металлов стекла способны обмениваться на Н+ - ионы, которые адсорбируются на тонкой стеклянной стенке (мембране) электрода. Если стеклянный электрод поместить в раствор с значением рН, отличающимся от рН раствора внутри электрода, то на стеклянной мембране возникает мембранный потенциал.
Стеклянный электрод, в паре с электродом сравнения (обычно применяют насыщенный хлорсеребряный электрод), опущенный в анализируемый раствор, образует электрохимическую ячейку. В этой ячейке стекло является электролитическим мостом с большим сопротивлением. Величина ЭДС в такой ячейке определяется соотношением активностей ионов водорода по обе стороны мембраны и при постоянстве их концентрации внутри стеклянного электрода зависит от концентрации ионов водорода в анализируемом растворе.
Стеклянные электроды широко применяются для измерения рН среды. Стеклянные электроды хранят в воде или в растворе КСl. Высыхание нарушает стабильную работу электрода и требует предварительного длительного замачивания.
Ионселективные мембранные электроды
Идеи, развитые в процессе создания стеклянного электрода, легли в основу разработки мембранных электродов, чувствительных к изменениям концентрации какого-либо одного иона. Ион-селективные электроды могут включать мембраны разных типов. Специальные сорта стекол, способные к ионному обмену на ионы Na+, K+, Li+, позволили создать электроды, чувствительные только к одному их указанных ионов.
При прессовании порошков некоторых солей (CuS, PbS, Ag2S), получены ион-селективные электроды на фтор, серу и др.
Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело к созданию ион-селективных электродов на бром, хлор, йод, избирательно адсорбирующих из раствора указанные ионы.
Получают распространение электроды с жидкой мембраной, представляющей собой пористую пластинку, пропитанную жидкостью, не смешивающейся с водой и способной к избирательной адсорбции определенных ионов.
Раздел прямой потенциометрии, где индикаторным электродом служит ионселективный электрод, называют ионометрией. Это удобный, простой, и экспрессный современный метод, продолжительность анализа 1-3 мин.
Водородный электрод
По международному соглашению в качестве стандартного электрода сравнения принят стандартный (нормальный) водородный электрод, потенциал которого условно принят равным нулю при любой температуре и при давлении газообразного водорода, равном 1 атм.
Водородный электрод можно получить, погрузив платиновый электрод в содержащий ионы водорода раствор, через который пропускают газообразный водород.
Водородный электрод малопригоден в аналитической практике из-за трудоемкости его приготовления, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого обычно определяют потенциалы других электродов.
Зависимость равновесного потенциала индикаторного электрода от состава раствора, описываемую уравнением Нернста, можно использовать для нахождения конечной точки титрования. Для этого измеряют потенциал после добавления каждой порции титранта. Из экспериментальных данных, записанных в виде таблицы, методом численной интерполяции, либо путем построения кривой титрования находят объем титранта, соответствующий точке эквивалентности. Кривая титрования может быть построена в интегральной форме, виде первой или второй производных.
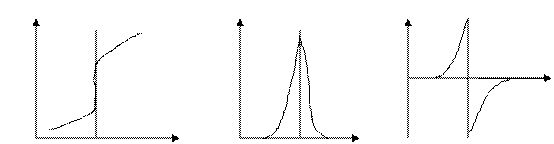 Е, мв ΔЕ/ΔV, мв Δ 2Е/ΔV2, мв
Е, мв ΔЕ/ΔV, мв Δ 2Е/ΔV2, мв
V,мл
В потенциометрическом титровании применимы кислотно-основные, окислительно-восстановительные реакции и реакции комплексообразования, а также процессы осаждения, протекающие быстро и количественно.
Метод потенциометрического титрования имеет ряд преимуществ перед прямой потенциометрией и титриметрией с визуальными индикаторами. В отличие от прямой потенциометрией здесь не существует искажения результатов за счет диффузионного потенциала (зависимость от подвижности ионов), кроме того, нет необходимости знать коэффициент активности определяемого иона.
К числу преимуществ перед визуальным титрованием прежде всего относятся исключение субъективных ошибок, возможность анализа мутных и окрашенных растворов, документальность и сравнительно легкая автоматизация. Основное преимущество заключается в возможности дифференцированного титрования компонентов смеси.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 1368; Нарушение авторских прав?; Мы поможем в написании вашей работы!