
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон разведения
|
|
|
|
Диссоциация растворенного вещества является процессом равновесным: 
То есть со временем устанавливается равновесие между непродиссоциированными молекулами и образовавшимися ионами (т. е. ионное равновесие).
Однако, рассматривая такие ионные равновесия в реальных растворах, необходимо каждый раз решать, можно ли в данном случае пользоваться уравнением для Кс диссоциации, справедливым для идеальных растворов (т. е. выраженным через С) или же в этом уравнении концентрации стоит заменить на активности?
На этой лекции мы и должны разобраться в каком виде использовать уравнение константы диссоциации для сильных электролитов, слабых электролитов, в зависимости от степени их разведения и т. д.
Рассмотрим пример диссоциации уксусной кислоты в воде. Раствор должен быть разбавленным (т. к. в концентрированном растворе α слабых электролитов мала).
С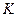 временем устанавливается ионное равновесие между непродиссоциировавшими молекулами и ионами
временем устанавливается ионное равновесие между непродиссоциировавшими молекулами и ионами

Константа равновесия, согласно закону действующих масс, равна:

Ка зависит от Т. Чем выше Т, тем больше Ка.
Т. к. раствор разбавленный, то количество растворителя – воды велико по сравнению с растворенным веществом – CH3COOH. Тогда можно считать, что 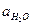 не изменяется и является постоянной:
не изменяется и является постоянной:  . Ее можно внести под знак константы:
. Ее можно внести под знак константы:
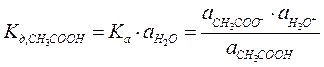
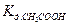 - термодинамическая константа диссоциации, выражается только через активности, учитывает взаимодействие между ионами и молекулами H2O. Применяется для описания реальных растворов. Зависит от Т (увеличивается Т, увеличивается Кд).
- термодинамическая константа диссоциации, выражается только через активности, учитывает взаимодействие между ионами и молекулами H2O. Применяется для описания реальных растворов. Зависит от Т (увеличивается Т, увеличивается Кд).
Вода – одновременно и растворитель и слабый электролит, способный частично диссоциировать на ионы.
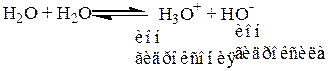
Тогда Ка константа равновесия для воды:
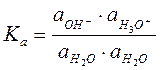
Поскольку H2O диссоциирует слабо, то концентрация Н3О+ и НО- мала по сравнению с молекулами H2O, то считаем, что активность недиссоциированных молекул H2O не изменяется, остается постоянной и ее можно внести под знак константы:
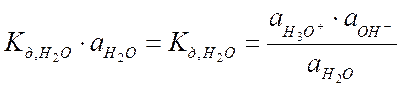

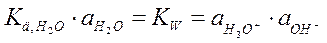
где KW - ионное произведение воды (справочная величина KW = 10-14).
Величина KW зависит от Т. При повышении Т значение KW непрерывно возрастает (при Т=0 – 20 0С величина KW увеличивается в раз).
Заменим в выражении Кд активности на произведение 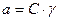 :
:

Обозначим 
 (1)
(1)
где КС – концентрационная (или кажущаяся) константа диссоциации, выражается только через С, не учитывает взаимодействие ионов в растворе, применяется для идеальных растворов (в частности для слабых электролитов).
Величина Кд для слабых кислот зависит от температуры. Но, в отличии от KW, с повышением Т значение Кд изменяется всего лишь на 3 – 8 %. Причем зависимость Кд от Т (в интервале 0 – 60 0С проходит через max). Т. к. зависит Кд от двух противоположных воздействий: 1) диссоциация протекает с поглощением Q, поэтому увеличение Т увеличивает диссоциацию; 2) с увеличением Т диэлектрическая проницаемость воды уменьшается, поэтому процесс диссоциации уменьшается, и процесс ассоциации ионов увеличивается. Пока преобладает первый фактор Кд увеличивается достигая max, затем начинает преобладать второй фактор и величина Кд уменьшается.
Формула (1) для разбавленных растворов сильных электролитов и для растворов слабых электролитов имеет вид:






 |  |
1= Кд не зависит от С
для незаряженных
частиц
Выразим величину КС через общую концентрацию электролита (С) и степень диссоциации (α):
 ;
;  ;
; 
Тогда
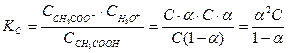

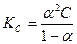
закон разведения Оствальда (1888 г.) (простейшая форма закона).
Суть закона Оствальда: чем меньше С электролита, тем больше его α, причем при бесконечном разведении величина α→1.
Чем выше КС, тем α меньше. Величина КС может служить мерой силы кислоты (мерой кислотности).
Умеренно слабые электролиты (H3PO4, Ca(OH)2): 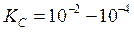
Слабые электролиты (CH3COOH, NH4OH): 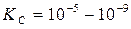
Очень слабые электролиты (H2O, C6H5OH):  .
.
 Если α << 1, то
Если α << 1, то 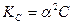 ;
; 
для слабых бинарных электролитов
Выразим закон разведения Оствальда через λ.
Известно, что для слабых электролитов: 
для разбавленных электролитов:  ,
,
где 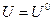 ,
,  (закон Кольрауша).
(закон Кольрауша).
 Разделим:
Разделим: 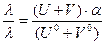
 для слабых электролитов.
для слабых электролитов.
Подставим значения α в уравнение Оствальда:
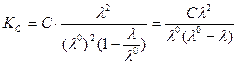
Получаем еще одну более сложную форму закона Оствальда:

 для слабых электролитов
для слабых электролитов
Величину КС и λ0 можно найти графически. После преобразования закона Оствальда получаем:

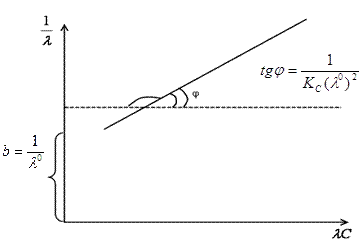 |
Строим график в координатах данного уравнения:
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 899; Нарушение авторских прав?; Мы поможем в написании вашей работы!