
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Амфотерные электролиты
|
|
|
|
Амфотерные электролиты (амфолиты) – это вещества, которые одновременно могут проявлять и кислотные, и основные свойства.
К амфотерным относятся две группы веществ:
1. вещества, у которых и кислотные, и основные свойства определяются одной и той же функциональной группой – ОН. К таким веществам можно отнести Zn(OH)2, Al(OH)3:

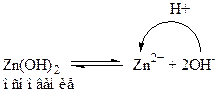
2. вещества, у которых кислотные и основные свойства определяются наличием разных функциональных групп. К таким вещества относятся аминокислоты типа NH2RCOOH. В водных растворах жирные аминокислоты полностью или частично переходят в форму: NH3+RCOO- - это ион, несущий одновременно и положительный и отрицательный заряд. Такие ионы называют амфиионы или внутренние соли или цвиттерионы.

Итак группа – СООН обеспечивает основные свойства аминокислот:
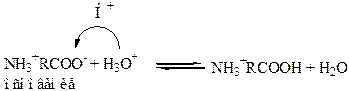
Группа – NH3 обеспечивает …………….

Ион NH3+RCOO- можно рассматривать как двух основную кислоту, способную диссоциировать в начале по карбоксильной группе, а затем по аминогруппе.
I ступень: 

II ступень: 

Поскольку КдI и КдII не одинаковы, то в водном растворе концентрации положительных и отрицательных ионов не одинаковы (т. е. раствор будет не электронейтрален и его невозможно исследовать).
В биохимии при исследовании белков необходимы условия, когда концентрации положительных и отрицательных ионов одинаковы. Для этого измеряют pH раствора аминокислоты, добавляя либо кислоту, либо основание, что позволит добавлять I или II ступень диссоциации.
Значение pH раствора амфолита (аминокислоты) становится таким, что в растворе образуется одинаковое количество положительных и отрицательных ионов.

Значение pH, при котором амфолит образует одинаковые концентрации отрицательных и положительных ионов, называется изоэлектрической точкой.
 Для ионов малых (с малым
Для ионов малых (с малым  ): Na+, K+, NO3-, ClO3- - гидратная оболочка велика, так как расстояние от эффективного точечного заряда в центре иона до диполей воды мало и, соответственно, притяжение велико. Уравнение Стокса не применимо для ионов с малым
): Na+, K+, NO3-, ClO3- - гидратная оболочка велика, так как расстояние от эффективного точечного заряда в центре иона до диполей воды мало и, соответственно, притяжение велико. Уравнение Стокса не применимо для ионов с малым  (чем ниже
(чем ниже 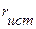 , тем больше rэфф. в растворе и соответственно меньше λi0).
, тем больше rэфф. в растворе и соответственно меньше λi0).
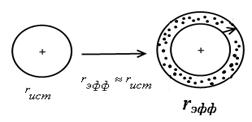 Для больших ионов гидратная оболочка мала. Уравнение Стокса применимо (чем больше r, тем меньше λi0) для больших слабо сольватированных ионов типа N(C3H7)4+.
Для больших ионов гидратная оболочка мала. Уравнение Стокса применимо (чем больше r, тем меньше λi0) для больших слабо сольватированных ионов типа N(C3H7)4+.
Недостатки уравнения Стокса:
1. Выводы по степени гидратации ионов в растворе носят качественный характер и могут быть применимы только к ионам большого размера;
2. Предпожение о однородности растворителя не верно, так как размер ионов приближается к размерам молекул растворителя (Н2О), а значит среда растворителя не может однозначно считаться однородной;
3. Два предыдущих пункта являются причиной несовпадения rst с 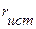
Электропроводность растворов электролитов увеличивается с повышением Т. λi0 большинства ионов в водном растворе увеличивается в 5 – 6 раз при повышение Т от 0 до 100 0С. Такая зависимость обусловлена уменьшением вязкости воды при повышении Т. Т. е. эквивалентна: чем меньше η, тем больше λi0, тогда их произведение  .
.
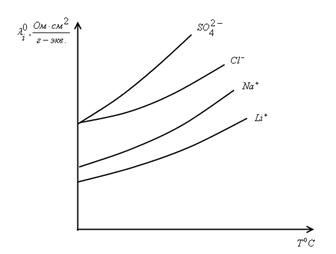 Пример:
Пример: 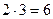

Если считать, что радиус сольватации иона в растворе не зависит от температуры, то из уравнение Стокса следует правило Вальдена-Писаржевского, согласно которому при любой температуре произведение представленной подвижности ионов на вязкость есть величина постоянная:


(при условии, что ri не зависит от Т).
Недостатки правила Вальдена-Писаржевского:
правило выполняется в широком интервале температур только для больших слабо сольватированных ионов, так как, во-первых, само уравнение Стокса не точное, а, во-вторых, r иона в растворе изменяется с Т.
В целом (на практике) 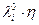 уменьшается не более чем на 25 % при повышении Т от 0 до 100 0С.
уменьшается не более чем на 25 % при повышении Т от 0 до 100 0С.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 8028; Нарушение авторских прав?; Мы поможем в написании вашей работы!