
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическая константа диссоциации. Применение теории Дебая-Хюккеля к слабым электролитам
|
|
|
|
При рассмотрении растворов слабых электролитов также необходимо учитывать ион-ионное и ион-дипольное взаимодействие. Поэтому для точного расчета ионного равновесия в процессе диссоциации применяют величину термодинамической константы диссоциации Кд:
 (разбавленный раствор)
(разбавленный раствор)

Согласно теории Дебая-Хюккеля, отличие активности от концентрации обусловлено только кулоновским взаимодействием. Поэтому для незаряженных частиц CH3COOH  , тогда
, тогда
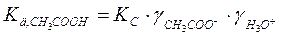
Вычисляем средний ионный коэффициент активности
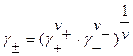 ;
;

Отсюда

Логарифмируем
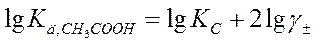
Применим теорию Дебая-Хюккеля и определим γ± согласно предельному закону Дебая-Хюккеля (т. к. раствор достаточно разбавлен):
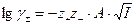 ;
; 
согласно
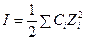 ;
; 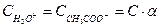


Тогда
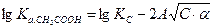 ;
;
т. к. для водного раствора при Т = 298 К величина А = 0,509, то

Т. о., используя теорию Дебая-Хюккеля для слабых электролитов получим линейную зависимость  от
от  :
:

 . Однако, согласно экспериментальным данным, такая зависимость выполняется только в области низких концентраций.
. Однако, согласно экспериментальным данным, такая зависимость выполняется только в области низких концентраций.
Т. о., теория Дебая-Хюккеля применима только к разбавленным растворам слабых электролитов, когда  линейно зависит от
линейно зависит от  , а величина
, а величина  не зависит от концентрации (т. к. это отрезок на оси Оу). В области концентрационных растворов зависимость перестает быть линейной, а значит теория Дебая-Хюккеля не применима.
не зависит от концентрации (т. к. это отрезок на оси Оу). В области концентрационных растворов зависимость перестает быть линейной, а значит теория Дебая-Хюккеля не применима.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1563; Нарушение авторских прав?; Мы поможем в написании вашей работы!