
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Определение истинной степени диссоциации. Вычисление степени и константы диссоциации слабых электролитов
|
|
|
|
 Степень диссоциации для слабых электролитов, выраженная через λ, рассчитывается по формуле:
Степень диссоциации для слабых электролитов, выраженная через λ, рассчитывается по формуле:
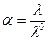
где α – кажущаяся степень диссоциации;
λ – эквивалентная электропроводность при данном разбавлении;
λ0 – эквивалентная электропроводность при бесконечном разбавлении.
Однако правильнее сопоставлять λ при данном разбавлении с электропроводностью λ/ неосуществимо на практике раствора с той же концентрацией, но полностью диссоциированного на ионы. Тогда истинную степень диссоциации( ) можно рассчитать по формуле:
) можно рассчитать по формуле:

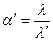
где λ – эквивалентная электропроводность раствора электролита при заданной концентрации;
λ/ - эквивалентная электропроводность неосуществившегося на практике раствора с той же концентрацией, но полностью продиссоциированного на ионы.
Сопоставляя эти две величины можно отметить что 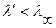 (т. к. при
(т. к. при 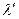 больше ионов и меньше их подвижность). Соответственно
больше ионов и меньше их подвижность). Соответственно 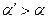 .
.
Для расчета 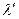 используется уравнение Онзагера:
используется уравнение Онзагера:
1) для разбавленных растворов сильных одно-одновалентных электролитов (при α = 1; полная диссоциация):
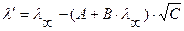 ;
;
где С – концентрация раствора, моль/л.
2) для разбавленных растворов слабых электролитов 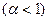 :
:
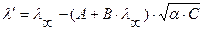
При Т = 298 К, в разбавленных растворах 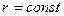 ,
, 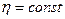 , тогда слагаемые А и В, в которых входят эти величины, тоже будут const. Уравнение Онзагера примет вид:
, тогда слагаемые А и В, в которых входят эти величины, тоже будут const. Уравнение Онзагера примет вид:
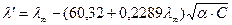
С учетом введенного понятия истинной степени диссоциации 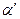 рассмотрим расчет α и Kд для слабых электролитов на примере бинарного слабого электролита CH3COOH (водный разбавленный раствор с С = 0,002 моль/л).
рассмотрим расчет α и Kд для слабых электролитов на примере бинарного слабого электролита CH3COOH (водный разбавленный раствор с С = 0,002 моль/л).
Алгоритм расчета:
1) вычисляем α слабого электролита CH3COOH (С = 0,002 моль/л):
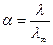
где λ – определяется экспериментально для 0,002 М раствора CH3COOH;
λ∞ - определяется по закону Кольрауша (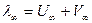 , где U∞ и V∞ - справочные величины).
, где U∞ и V∞ - справочные величины).
Уточняем полученное значение α (кажущаяся степень диссоциации), рассчитывая истинную степень диссоциации 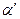 :
:
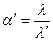
где λ/ - эквивалентная электропроводность неосуществившегося на практике раствора 0,002 М, CH3COOH полностью продиссоциированного на ионы. Определяем по формуле Онзагера:
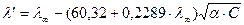
Затем повторяем расчет:
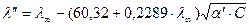
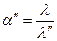
Степень диссоциации считается ионной, если ее величина после очередной подстановки совпадает с предыдущим значением. Как правило требуется для этого 3 – 4 подстановки.
2) Используя истинное значение α, находим КС по закону разведения Оствальда:
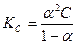
3) Затем термодинамическую константу диссоциации:
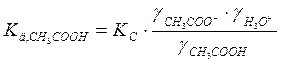
а) если сильно разбавленный раствор электролита (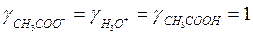 ):
):
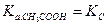
б) если разбавленный раствор электролита
(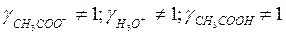 ):
):
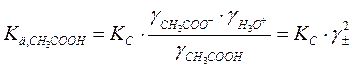
где γ± - средний ионный коэффициент активности, который определяется по формуле Гюнтельберга
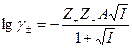
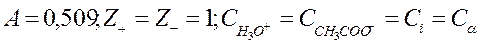
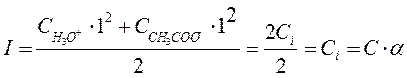
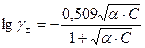
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 998; Нарушение авторских прав?; Мы поможем в написании вашей работы!