
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теория кислот и оснований Бренстеда
|
|
|
|
Кислоты и основания. Протолитическое равновесие. Гидролиз.
Что такое кислота? Что такое основание? Мы считаем, что основание – это вещество, принимающее протон Н+, а кислота – это вещество, отдающее протон Н+. Однако, такое определение справедливо только для водных растворов. В других растворителях эти определения неточны. Потому было создано много теорий (Бренстеда, Льюиса, Усановича и др.), где эти понятия уточняются.
Наиболее широко применима теория Бренстеда как теория, которая легла в основу современных представлений о кислотах и основания. Для электрохимии также важна теория Бренстеда, так как она верно описывает поведение кислот и оснований в водных растворах (наиболее широко применимых в электрохимии), а во вторых основываясь именно на теорию Бренстеда Аррениус создал свою теорию электролитический диссоциации.
Кислота – это вещество, способное отдавать Н+.
Основание – это вещество способное принимать Н+.
Кислота и основание связаны уравнением:
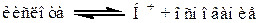
Пример:
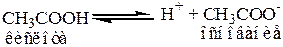
Кислота и основание, входящие в данное уравнение называются сопряженными.
Образующийся Н+ протон водорода не может существовать отдельно и должен содержаться с молекулой растворителя – воды:

Т. о., согласно Бренстеду, растворитель должен либо принимать Н+ (проявляя основные свойства), либо отдавать Н+ (проявляя кислотные свойства). Только в таком растворителе вещество может проявлять либо кислотные, либо основные свойства.
В этом случае кислотно-основное взаимодействие можно представить как:
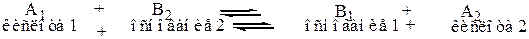
Пример:
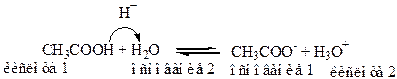

H2O - это амфипротонный растворитель, способный и принимать и отдавать Н+.
Вещество А, отдав Н+ превращается в вещество В1, а вещество В2 приняв протон Н+ превращается в А2.
CH3COOH, CH3COO-, и H2O и H3O+ - это пары сопряженных кислот и оснований.
Реакции, в которых происходит переход Н+, называются протолитическими.
В протолитической реакции между двумя парами сопряженных кислот и оснований возникает равновесие, которое называется двойным протолитическим равновесием (или просто протолитическим равновесием).
Недостаток теории Бренстеда: теория не распространяется на соединения, которые не способны ни присоединять, ни отдавать Н+, но при этом обладающие выраженными кислотами или основными свойствами. К таким веществам можно отнести BF3, AlCl3, SO3. Эти апротонные соединения, вступающие в равновесные реакции с основаниями, называются кислотами Льюиса. Такие соединения описываются электронной теорией кислот Льюиса.
Итак, согласно теории Бренстеда, в реакциях между кислотой и основанием устанавливается протолитическое равновесие, которое возникает между двумя парами сопряженных кислот и оснований. Такое равновесие характерно для реакций диссоциации и гидролиза. Рассмотрим каждую из них.
а) реакция диссоциации CH3COOH:

Константа протолитического равновесия равна:

Двойное протолитическое равновесие есть результат двух сопряженных равновесий:
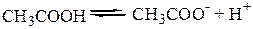

Запишем константы каждого из этих равновесий:
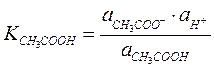
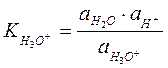
где  ,
, 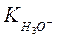 - истинные термодинамические константы диссоциации или константы кислотности.
- истинные термодинамические константы диссоциации или константы кислотности.
Величина  и
и  отличаются.
отличаются.  учитывает взаимодействие ион-ионное и ион-дипольное (с молекулами H2O), а
учитывает взаимодействие ион-ионное и ион-дипольное (с молекулами H2O), а  учитывает только ион-ионное взаимодействие и не учитывает взаимодействие с молекулами воды. Однако, в разбавленных водных растворах для слабых кислот
учитывает только ион-ионное взаимодействие и не учитывает взаимодействие с молекулами воды. Однако, в разбавленных водных растворах для слабых кислот 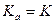 .
.
Тогда, Ka равно отношению констант кислотности уксусной кислоты и иона гидроксония:
 ;
;
б) реакция гидролиза
- соли, образованные слабой кислотой и сильным основанием
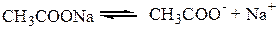
(раствор разбавлен, соль диссоциирует полностью)
Образующийся ион CH3COO-, вследствие того, что CH3COOH слабая кислота, проявляет основные свойства и способны принимать Н+ от молекул растворителя – H2O.
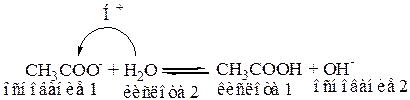
(В результате гидролиза раствор соли имеет щелочную среду).
Константа протолитического равновесия равна:

Т. к. раствор разбавленный, то 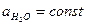 :
:

Кг – константа гидролиза.
Выразим Кг через , КW. Умножим все на
, КW. Умножим все на 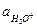 :
:
=КW





 = Kд
= Kд


Отношение концентрации образовавшегося гидроксония к начальной концентрации соли называется степенью гидролиза β:

Найдем зависимость Кг от β для бинарного 1-1-валентного элемента 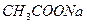 :
:

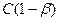
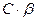
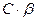
где  (общая концентрация соли)
(общая концентрация соли)
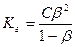
- соли, образованные слабым основанием и сильной кислотой:
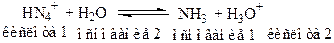
После гидролиза раствор соли имеет кислую среду.


Рассуждения аналогичны предыдущему случаю.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1462; Нарушение авторских прав?; Мы поможем в написании вашей работы!