
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Cu+2O + 2N–3H3 3Cu0 + N20 + 3Н2O !!!
|
|
|
|
4. Водный раствор аммиака осаждает некоторые металлы в виде гидроксидов:
AlCl3 + 3NH3 + 3H2O = Al(OH)3↓ + 3NH4Cl
4. Аммиак реагирует с активными металлами;
2Na+2NH3 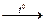 2NaNH2+H2
2NaNH2+H2
6Ca+2NH3→Ca3N2+3CaH2
Соли аммония
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства Кристаллические вещества, хорошо растворимые в воде.
Получение Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3  NH4NO3(нитрат аммония)
NH4NO3(нитрат аммония)
2NH4OH + H2SO4  (NH4)2SO4(cульфат аммония) + 2Н2O
(NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl  NH4+ + Cl-
NH4+ + Cl-
2. Разложение при нагревании.
a) если кислота летучая NH4Cl 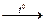 NH3 + HCl NH4HCO3
NH3 + HCl NH4HCO3 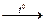 NH3 + Н2O + CO2
NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 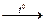 N2O + 2Н2O (NH4)2Cr2O7
N2O + 2Н2O (NH4)2Cr2O7 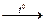 N2 + Cr2O3 + 4Н2O
N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 CO32- + 2H+ →Н2O + CO2
б) (NH4)2SO4 + Ba(NO3)2 → BaSO4↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4↓ + 2NH4+ + 2NO3- Ba2+ + SO42- → BaSO4↓
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая: NH4Cl + Н2O ↔ NH4OH + HCl NH4+ + Н2O ↔ NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH 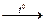 NaCl + NH3 + Н2O
NaCl + NH3 + Н2O
Оксиды азота: N2+1O N+2O N2+3O3 N+4O2 N2+5O5
Оксид азота (I)
N2+1O закись азота, "веселящий газ"
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t0пл.= -910C, t0кип.= -88,50С. Анестезирующее средство.
Получение NH4NO3 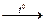 N2O + 2Н2O
N2O + 2Н2O
Химические свойства
1. Разлагается при 7000C с выделением кислорода: 2N2+1O 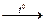 2N20 + O20
2N20 + O20
поэтому он поддерживает горение и является окислителем
2. С водородом: N2+1O + H2 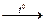 N20 + Н2O
N20 + Н2O
3. Несолеобразующий оксид
Оксид азота (II) N+2O
Газ, бесцветный, плохо растворим в воде, t0пл.= -1640C, t0кип.= -1520С
Получение
1. Каталитическое окисление аммиака (промышленный способ)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 615; Нарушение авторских прав?; Мы поможем в написании вашей работы!