
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
NH3 + 5O2 4NO + 6H2O
|
|
|
|
б) Окисление кислородом воздуха NO до NO2: 2NO + O2 → 2NO2
в) Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O → 4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует:
с основными оксидами CuO + 2HNO3 → Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- → Cu2+ + 2NO3- + H2O или CuO + 2H+ → Cu2+ + H2O
с основаниями HNO3 + NaOH → NaNO3 + H2O H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
или H+ + OH- → H2O
вытесняет слабые кислоты из их солей 2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2 2H+ + СO32- → H2O + CO2
Специфические свойства азотной кислоты
Сильный окислитель
1. Разлагается на свету и при нагревании 4HNO3 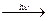 2H2O + 4NO2 + O2
2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция")
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ
в) HNO3 – окислитель.
Продукты восстановления HNO3 зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень окисления имеет азот (N) в продуктах восстановления HNO3:
| восстановитель концентрация HNO3 | щелочные и щелочноземельные металлы | тяжелые металлы |
| разбавленная кислота | N–3H4NO3 | N+2O |
| концентрированная кислота | N2+1O | N+4O2 |
HNO3 не взаимодействует с Au, Pt, Ir, Os.
HNO3(конц.) взаимодействует с Al, Cr, Fe ТОЛЬКО при t°
NO3- + 2H+ + 1e → NO2 + H2O, (1)
NO3- + 4H+ + 3e → NO + 2H2O, (2)
2NO3- + 10H+ + 8e → N2O + 5H2O, (3)
2NO3- + 12H+ + 10e → N2 + 6H2O, (4)
NO3- + 10H+ + 8e → NH4+ + 3H2O. (5)
***С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот: S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O (нагревание)
B0 + 3HNO3 →H3B+3O3 + 3NO2 3P0 + 5HNO3 + 2H2O(разб) →5NO + 3H3P+5O4
I2+10HNO3(к) ®2HIO3+10NO2 ↑+4H2O 3I2+10HNO3(разб) ®6HIO3+10NO↑+2H2O
5. Азотная кислота окисляет сложные вещества; при этом может происходить окисление одного из элементов: FeO + 4HNO3(конц) ®Fe(NO3)3 + NO2 + 2H2O
или двух атомов одновременно: Cu+12S-2 + 14HNO3(конц) → 2Cu+1(NO3)2 + H2S+6O4 + 10NO2↑+ 6H2O
«Царская водка»
HNO3 (конц) + 3HCl (конц) ↔NOCl + 2Cl0 + 2H2O (комн. темп)
2HNO3 (конц) + 6HCl (конц)→2NO + 3Cl2 + 4H2O
HNO3 (конц) + 4HCl (конц) + Au →H[AuCl4] + NO + 2H2O
4HNO3 (конц) + 18HCl (конц) + 3Pt →3H2[PtCl6] + 4NO + 8H2O
NOCl – оранжево–желтый газ, желтовато–красная жидкость, термически неустойчивое вещество, разлагается при комнатной температуре:
2NOCl ↔2NO + Cl2 Сильно корродирует металлы: 3NOCl + Fe → FeCl3 + 3NO (при комн. темп.)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 766; Нарушение авторских прав?; Мы поможем в написании вашей работы!